分析:A、二氧化碳中碳原子与氧原子之间形成2对共用电子对,满足8电子稳定.
B、共用电子对用短线“-”代替,为结构式,省略C-H键即为结构简式.
C、比例模型主要表现原子相对大小,空间结构,大致体现原子的连接顺序,不能体现成键类型.
D、氯原子得1个电子形成氯离子,质子数不变.
解答:解:A、碳原子最外层有4个电子,要达到稳定结构要形成四对共用电子对,电子式为
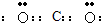
而,题中给出的电子式中碳原子只有两对共用电子对,故A错误;
B、

乙烷的结构简式,乙烷结构式为

,故B错误;
C、由图可知大球为碳原子,小球为氢原子,符合碳原子比氢原子大,并且也符合甲烷空间结构,故C正确;
D、氯原子得1个电子形成氯离子,质子数不变为17,核外电子数为18,故D错误.
故选:C.
点评:考查常用化学用语,难度较小,注意常用化学用语的书写,注意B中结构式与结构简式容易忽略混用.

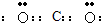 而,题中给出的电子式中碳原子只有两对共用电子对,故A错误;
而,题中给出的电子式中碳原子只有两对共用电子对,故A错误; 乙烷的结构简式,乙烷结构式为
乙烷的结构简式,乙烷结构式为 ,故B错误;
,故B错误;
