
【题目】浓硫酸和碳在一定温度下反应会生成二氧化碳和二氧化硫和水。
(1)其化学方程式为___。
(2)浓硫酸在反应中表现出来的性质是___。
(3)产生0.1molCO2,转移电子的物质的量为___mol。
(4)若在反应中共转移了4mol电子,则标况下生成气体的总体积为___L。
【答案】![]() 强氧化性 0.4 67.2
强氧化性 0.4 67.2
【解析】
(1)已知浓硫酸和碳在一定温度下反应会生成二氧化碳和二氧化硫和水的反应,故该反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)在反应中H2SO4中硫元素全部由+6价到+4价,化合价降低,被还原,故表现出来的性质是强氧化性,故答案为:强氧化性;
(3)C由0价转化为+4价产生CO2,每生成1mol CO2失去4mol电子,故生成0.1mol CO2时,转移电子的物质的量为0.4mol,故答案为:0.4;
(4)通过分析反应方程式可知,若在反应中共转移了4mol电子,则生成1mol CO2,2mol SO2,故标况下生成气体的总体积为![]() ,故答案为:67.2。
,故答案为:67.2。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】某高分子化合物R的结构简式如图,下列有关R的说法正确的是

A. R的单体之一的分子式为C9H12O2
B. R可通过加聚和缩聚反应合成,R完全水解后生成2种产物
C. R是一种有特殊香味,难溶于水的物质
D. 碱性条件下,1 mol R完全水解消耗NaOH的物质 的量为n(m+1)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组查阅资料得知:保险粉(Na2S2O4)和KOH的混合溶液能定量吸收O2;CuCl的盐酸溶液能定量吸收CO,且易被O2氧化。拟设计实验方案,采用上述两种溶液和KOH溶液及量气装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。下列说法不正确的是( )
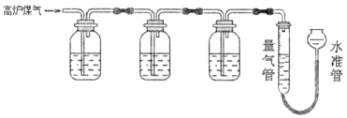
A.采用上述3种吸收剂,气体被逐一吸收的顺序应该是CO2、O2和CO
B.保险粉(Na2S2O4)和KOH的混合溶液吸收O2的离子方程式为2S2O42-+3O2+4OH-=4SO42-+2H2O
C.当三种气体被逐一吸收后,导出的气体中可能含有HCl
D.其他两种吸收剂不变,O2的吸收剂可以用灼热的铜网替代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物分子结构式如下图,下列说法正确的是( )
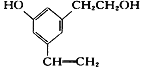
A. 取少量该有机物,滴加酸性高锰酸钾溶液,微热,有气体产生
B. 所有的碳原子不可能处在同一个平面上
C. 所有的氧原子不可能同时处在苯环平面上
D. 所有的氢原子有可能同时处在苯环平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。合理应用和处理碳、氮及其化合物,在生产生活中有重要意义。
(1)对温室气体CO2的研究一直是科技界关注的重点。在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一。
已知:①H2和CH4的燃烧热分别为285.5kJ/mol和890.0kJ/mol。
②H2O(1)=H2O(g) ΔH=+44kJ/mol
试写出H2还原CO2生成CH4和H2O(g)的热化学方程式__。
(2)CO2在CuZnO催化下,可同时发生如下的反应I、II,可作为解决温室效应及能源短缺的重要手段。
I.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-57.8kJ/mol
CH3OH(g)+H2O(g) ΔH1=-57.8kJ/mol
II.CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2kJ/mol
CO(g)+H2O(g) ΔH2=+41.2kJ/mol
在CuZnO存在的条件下,保持温度T不变,在一刚性密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量如下表:
CO2 | H2 | CH3OH | CO | H2O(g) | 总压/kPa | |
起始/mol | 5.0 | 7.0 | 0 | 0 | 0 | p0 |
平衡/mol | n1 | n2 | p |
若反应I、II均达平衡时,p0=1.2p,则表中n1=__,此时n2=3.则反应I的平衡常数Kp=__(无需带单位,用含总压p的式子表示。已知:气体各组分的分压p(B),等于总压乘以其体积分数)。
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)![]() CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是__;300~400℃时,乙酸的生成速率升高的主要原因是__。
CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是__;300~400℃时,乙酸的生成速率升高的主要原因是__。

(4)用活性炭还原法可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH>0在T℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) ΔH>0在T℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
c(NO)/molL1 | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
c(N2)/molL1 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
c(CO2)/molL1 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
30min后,只改变某一条件,根据上表的数据判断改变的条件可能是__填字母)。
A.通入一定量的CO2
B.加入合适的催化剂
C.适当缩小容器的体积
D.通入一定量的NO
E.加入一定量的活性炭
F.适当升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制500mL0.2mol/LNaOH溶液,实验操作步骤为:
A.把制得的溶液小心地转移至容量瓶中。
B.在天平上称取 g的氢氧化钠钠固体,把它放在烧杯中,用适量的蒸馏水将它完全溶解并冷却至室温。
C.继续向容量瓶中加蒸馏水至 ,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为___(填序号)。
(2)题目B、C项空白处填入。___、___。
(3)本实验用到的基本仪器已有烧杯、天平(砝码、镊子)、玻璃棒,还缺少的必要仪器是___。
(4)下列情况中,会使所配溶液浓度偏高的是___(填序号)。
A.没有冷却直接移液
B.没有进行上述的操作步骤D
C.加蒸馏水时,不慎超过了刻度线
D.容量瓶使用前内壁沾有水珠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修2:化学与技术]
双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:


A.氢化釜 | B.过滤器 | C.氧化塔 | D.萃取塔E.净化塔F.工作液再生装置G.工作液配制装置 |
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是_______,循环使用的|原料是______,配制工作液时采用有机溶剂而不采用水的原因是______。
(2)氢化釜A中反应的化学方程式为_______,进入氧化塔C的反应混合液中的主要溶质为_______。
(3)萃取塔D中的萃取剂是____,选择其作萃取剂的原因是______。
(4)工作液再生装置F中要除净残留的H2O2,原因是______。
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为_______。一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符的是( )
A.向AlCl3溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B.向氯化铁溶液中滴加KSCN溶液显红色:Fe3++3SCN-![]() Fe(SCN)3
Fe(SCN)3
C.将nmolCl2通入含有nmolFeBr2的溶液中:2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:
含氧酸酸性强弱与非羟基氧原子数的关系
次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
含氧酸 | Cl—OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
(1)已知,亚磷酸是中强酸,亚砷酸是弱酸且有一定的弱碱性,则H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是①_____________________________,②__________________________________。
(2)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况______________,写出化学方程式:____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com