
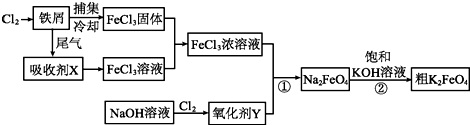
分析 氯气与铁反应生成三氯化铁,冷却得到三氯化铁固体,尾气中含有氯气,用氯化亚铁溶液吸收得到氯化铁溶液,把氯化铁固体溶于吸收液得到浓氯化铁溶液,氯气与氢氧化钠溶液反应生成次氯酸钠溶液,次氯酸钠具有强氧化性,与氯化铁溶液反应生成Na2FeO4,然后向该溶液中加饱和的KOH溶液,析出固体K2FeO4,
(1)①氯化铁做净水剂是因为Fe3+水为Fe(OH)3胶体的缘故;
②工业上常用FeCl3溶液腐蚀铜印刷线路板是Fe3+氧化了Cu的缘故;
(2)吸收剂X的与Cl2反应的产物是FeCl3,X是FeCl2;Cl2与氢氧化钠反应生成NaClO和NaCl,其中NaClO能做氧化剂;
(3)碱性条件下根据反应物和产物及元素守恒和电荷守恒可写出反应①的离子方程式;
(4)根据溶解度大小分析可知,在反应中溶解度小的物质先析出,会促进反应的进行;
(5)K2FeO4 在水溶液中易发生反应:4FeO42-+10H2O═4Fe(OH)3+8OH-+3O2↑,所以用碱液来洗涤,抑制水解,不引入新的杂质所以用稀KOH溶液,异丙醇易挥发;
(6)根据反应①②③可知:2FeO42-~~~~6Fe2+,根据关系式计算出K2FeO4的物质的量和质量,再计算质量分数.
解答 解:(1)①氯化铁做净水剂是因为Fe3+水为Fe(OH)3胶体的缘故,原理为Fe3++3H2O?Fe(OH)3(胶体)+3H+,故答案为:Fe3++3H2O?Fe(OH)3(胶体)+3H+;
②工业上常用FeCl3溶液腐蚀铜印刷线路板,是Fe3+氧化了Cu的缘故,反应方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)吸收剂X的与Cl2反应的产物是FeCl3,X是FeCl2;Cl2与氢氧化钠反应生成NaClO和NaCl,其中NaClO能做氧化剂,所以Y为NaClO,故答案为:FeCl2;NaClO;
(3)碱性条件下根据反应物和产物可知,反应①的离子方程式为3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;故答案为:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品,该反应的化学方程式为2KOH+Na2FeO4 =K2FeO4+2NaOH,反应能发生的原因是K2FeO4溶解度小,析出晶体,促进反应进行;故答案为:K2FeO4溶解度小,析出晶体,促进反应进行;
(5)K2FeO4 在水溶液中易发生反应:4FeO42-+10H2O═4Fe(OH)3+8OH-+3O2↑,所以用碱液来洗涤,抑制水解,不引入新的杂质所以用稀KOH溶液,异丙醇易挥发,故选B;
(6)根据反应①②③可知:2FeO42-~~~~6Fe2+,
1mol 3mol
n 0.1000mol/L×0.01893L
则n=6.31×10-4mol,所以样品中高铁酸钾的质量分数为63.1%;故答案为:63.1%.
点评 本题考查了物质的制备流程的理解应用、实验基本操作、物质性质的分析应用、有关方程式的计算、氧化还原反应等,题目涉及的知识点较多,侧重于考查学生的实验能力和对基础知识的综合应用能力,熟练掌握基础是关键,题目难度中等


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 检验NH4+:滴入NaOH溶液后,加热,用湿润红色石蕊试纸检验发现变蓝 | |
| B. | 检验Cl-:确定溶液中无SO42-后,加入AgNO3溶液后出现白色沉淀 | |
| C. | 检验Na+:将干净的铂丝蘸取少量溶液在酒精灯上灼烧,观察火焰呈浅紫色 | |
| D. | 检验SO42-:加入BaCl2溶液出现白色沉淀,再加足量稀盐酸沉淀不溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8g Na2S和7.8g Na2O2中含有的阴离子数均为0.1NA | |
| B. | 0.1mol•L-1的NaHSO4溶液中含有阳离子物质的量为0.2mol | |
| C. | 常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L | |
| D. | 1.8g ${\;}_{8}^{18}$O2分子与1.6g ${\;}_{8}^{16}$O2分子中含有的中子数均为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:A>B>C>D | B. | 单质熔点:D>B,A>C | ||
| C. | 原子半径:C>B>D>A | D. | 简单离子半径:C>A>D>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,阴极质量增加6.4g,电路中电子转移的总数为0.2NA | |
| B. | 6.0gSiO2晶体中含有0.2NA个Si-O键 | |
| C. | 10g 46%乙醇溶液中含氧原子0.1NA | |
| D. | 苯与液溴反应生成1mol 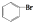 时消耗0.5NA个Br2 时消耗0.5NA个Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com