
分析 ①将部分粉末加入水中,振荡,有白色沉淀产生,则Ba(NO3)2、CaCl2至少一种,K2CO3、Na2SO4至少一种:
②向①的悬浊液中加入过量稀盐酸,白色沉淀部分溶解,并有气泡放出,则不溶解的沉淀为硫酸钡,生成气体为二氧化碳,则一定存在Ba(NO3)2、K2CO3、Na2SO4:
③取少量②的上层清液滴入硝酸银溶液,有白色沉淀生成,应为AgCl沉淀,但加入盐酸,引入氯离子,不能确定是否含有氯化钙,以此解答该题.
解答 解:①将部分粉末加入水中,振荡,有白色沉淀产生,则Ba(NO3)2、CaCl2至少一种,K2CO3、Na2SO4至少一种:
②向①的悬浊液中加入过量稀盐酸,白色沉淀部分溶解,并有气泡放出,则不溶解的沉淀为硫酸钡,生成气体为二氧化碳,则一定存在Ba(NO3)2、K2CO3、Na2SO4:
③取少量②的上层清液滴入硝酸银溶液,有白色沉淀生成,应为AgCl沉淀,但加入盐酸,引入氯离子,不能确定是否含有氯化钙,
(1)由以上分析可知一定含有Ba(NO3)2、K2CO3、Na2SO4,不能确定是否含有CaCl2,故答案为:Ba(NO3)2、K2CO3、Na2SO4;CaCl2;
(2)一定含有Ba(NO3)2、K2CO3、Na2SO4,溶于水可发生Ba2++CO32-=BaCO3↓、Ba2++SO42-=BaSO4↓,加入盐酸反应BaCO3+2H+=Ba2++H2O+CO2↑,③加入硝酸银发生Ag++Cl-=AgCl↓,
故答案为:Ba2++CO32-=BaCO3↓、Ba2++SO42-=BaSO4↓、BaCO3+2H+=Ba2++H2O+CO2↑、Ag++Cl-=AgCl↓.
点评 本题考查物质检验和鉴别,为高频考点,把握物质的性质及实验现象为解答的关键,侧重分析推断能力及知识综合应用能力的考查,注意常见离子的检验方法,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
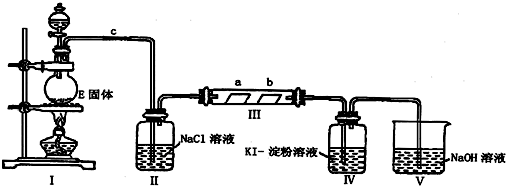
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一个反应能否自发进行,由焓变、熵变、反应温度共同决定 | |
| B. | 在同一条件下,不同物质有不同的熵变,其体系混乱度越大,熵值越小 | |
| C. | 自发进行的反应一定能迅速发生 | |
| D. | 低温时,吸热且熵减的反应可能会自发发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
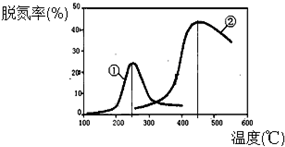
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 证明醋酸的酸性比碳酸强:2CH3COOH+CaCO3═Ca2++H2O+2CH3COO-+CO2↑ | |
| B. | 证明FeCl2溶液已变质:Fe3++3SCN-═Fe(SCN)3 | |
| C. | 证明Al(OH)3有酸性:Al( OH)3+NH3•H2O═AlO2-+NH4++2H2O | |
| D. | 证明氧化性Fe3+>Cu2+:2Fe3++Cu═Cu2++2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏法可实现海水的淡化 | |
| B. | 乙醇可以用作“提取碘水中的碘”的萃取剂 | |
| C. | 用“蒸发结晶”的方法从氯化钠溶液中分离得到氯化钠晶体 | |
| D. | 除去氧化铁中的氧化铝杂质:用NaOH溶液浸泡,再过滤、洗涤、干燥,即可得到纯净氧化铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com