
下列物质中,物质的水溶液能导且该物质属于非电解质,溶于水时化学键被破坏的是( )
A.氯化氢 B.蔗糖 C.干冰 D.硫酸钡
科目:高中化学 来源:2013-2014山东省济宁市高一5月质量检测化学试卷(解析版) 题型:选择题
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
A.X、Y、Z、W的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市3月质量检测高一化学试卷(解析版) 题型:选择题
下列各组元素中,原子半径依次增大的是:( )
A. I、Br、ClB. Al、Si、PC. O、S、NaD. C、N、B
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市高二年级第二学期阶段考试化学试卷(解析版) 题型:选择题
某同学在实验报告中记录下列数据,其中正确的( )
A.用25mL量筒量取18.63mL盐酸
B.用托盘天平称取12.15克食盐
C.标准的NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液32.30mL
D.用广泛pH试纸(1~14)测得某溶液pH为5.5
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市高二5月月考化学试卷(解析版) 题型:填空题
(每空2分,共10分)近年,国际原油价格大幅上涨,促使各国政府加大生物能生产,其中酒精汽油已进入实用化阶段。
(1)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成X,X可发生银镜反应,请写出X被银氨溶液氧化的反应方程式(标出具体反应条件):______________________________________。
(2)乙醇可以与酸性重铬酸钾溶液反应,被直接氧化成Y,Y含有官能团的名称是________。在浓硫酸存在下加热,乙醇与Y反应可生成一种有香味的物质W,化学方程式为________________________________________。
(3)现有两瓶无色液体,分别盛有Y、W,只用一种试剂就可以鉴别,该试剂可以是____________________________________。
(4)现代石油化工采用银作催化剂,乙烯能被氧气氧化生成环氧乙烷(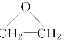 )该反应的原子利用率为100%,反应的化学方程式为___________。
)该反应的原子利用率为100%,反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市高二5月月考化学试卷(解析版) 题型:选择题
乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂键的说明,正确的是( )
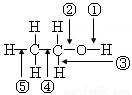
A.与金属钠作用时,键②断裂
B.与浓硫酸共热至170 ℃时,键①和⑤断裂
C.与乙酸、浓硫酸共热时,键①断裂
D.在铜催化下和氧气反应时,键①和②断裂
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济南市高三5月针对性训练理综化学试卷(解析版) 题型:简答题
(18分)碱金属元素的单质及其化合物被广泛应用于生产、生活中。
②一定量的Na在足量O2中充分燃烧,参加反应的O2体积为5.6 L(标准状况),则该反应过程中转移电子的数目为_________。
(2)金属锂广泛应用于化学电源制造,锂水电池就是其中的一种产品。该电池以金属锂和 钢板为电极材料,以LiOH为电解质,加入水即可放电。
总反应为:2Li+2H2O=2LiOH+H2↑
①锂水电池放电时,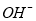 向_________极移动。
向_________极移动。
②写出该电池放电时正极的电极反应式:_________________。
③电解熔融LiCl可以制备金属Li。但LiC1熔点在873 K以上,高温下电解,金属Li产量极低。经过科学家不断研究,发现电解LiCl—KCl的熔盐混合物可以在较低温度下生成金属Li。
你认为,熔盐混合物中KCl的作用是_________________________________________。
写出电解该熔盐混合物过程中阳极的电极反应式:______________________________。
(3)最新研究表明,金属钾可作工业上天然气高温重整的催化剂,有关反应为:
 。一定温度下,向2 L容积不变的密闭容器中充入4 mol
。一定温度下,向2 L容积不变的密闭容器中充入4 mol 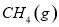 和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。
和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。

①0~10 min内用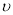 (CO)表示的化学反应速率为_________。
(CO)表示的化学反应速率为_________。
②下列叙述中,能够证明该反应已达到平衡状态的是_________(填序号)。
a.生成3 molH-H键的同时有4 molC-H键断裂
b.其他条件不变时,反应体系的压强保持不变
c.反应混合气体的质量保持不变
d.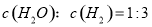
③此温度下,该反应的化学平衡常数K=_________mo12·L-2。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省日照市高三5月二模理综化学试卷(解析版) 题型:选择题
下列有关实验的描述正确的是
A.用湿润的pH试纸测定溶液的pH,测定结果偏小,该溶液一定呈酸性
B.中和滴定实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须干燥 或用待装液润洗后方可使用
C.将碘水倒入分液漏斗,加入适量乙醇,振荡后静置,能将碘萃取到乙醇中
D.向含有FeCl2杂质的FeCl3溶液中通入足量C12后,充分加热蒸干,可得到纯净的FeCl3固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com