
【题目】根据右边反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。工业上制取漂白粉的反应也在其中。
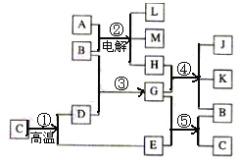
(1)单质L是_____ 。
(2)化合物B是____。
(3)图中除反应①以外,还有两个用于工业生产的反应,是________和_______(填代号)。
请写出他们的化学反应方程式:____________、____________。
【答案】H2 H2O ② ④ 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 2 Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2NaOH+H2↑+Cl2↑ 2 Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】
从框图中看,反应①是工业上煅烧石灰石的反应,反应⑤是实验室鉴定化合物E的反应,则C为CaCO3,E为CO2,D为CaO,G为Ca(OH)2,B为H2O;反应②是工业制烧碱的反应,则A为NaCl,H为Cl2,L为H2,M为NaOH;反应④为制漂白粉的反应,则K和J中一种为CaCl2,一种为Ca(ClO)2,据此分析作答。
根据上述分析可知,
(1)单质L是H2。故答案为:H2;
(2)化合物B是H2O。故答案为:H2O;
(3)图中除反应①以外,还有两个用于工业生产的反应,是②和④。
化学反应方程式:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
2NaOH+H2↑+Cl2↑;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
故答案为:②和④;2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
2NaOH+H2↑+Cl2↑;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)有机物 的系统命名是________________________________________________________________________,
的系统命名是________________________________________________________________________,
将其在催化剂存在下完全氢化,所得烷烃的系统命名是________________________________________________________________________。
(2)有机物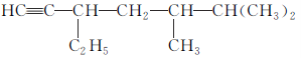 的系统命名是________________________________________________________________________,
的系统命名是________________________________________________________________________,
将其在催化剂存在下完全氢化,所得烷烃的系统命名是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法和解释错误的是
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物![]() 从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能说明醋酸是弱电解质的是 ( )
A. 醋酸能使石蕊溶液变红
B. ![]() 时.
时.![]() 醋酸的pH约为3
醋酸的pH约为3
C. 向醋酸中加入氢氧化钠溶液,溶液pH增大
D. 醋酸能与碳酸钙反应产生![]() 气体
气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列 6 种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为了确认溶液的组成,进行了如下实验:
①取 200mL 上述溶液,加入足量 BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀 4.30g。向沉淀中加入过量的盐酸,有2.33g沉淀不溶解。
②向①的滤液中加入足量NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体1.12L (已换算成标准状况,假定产生的气体全部逸出)。
③原溶液焰色反应呈黄色。
关于原溶液组成的结论,不正确的是
A.一定存在Cl-、SO42-、CO32-、NH4+,可能存在Na+、K+
B.至少存在五种离子,且c(Cl-)≥0.05mol/L
C.c(CO32-)=0.05mol/L
D.c(NH4+)>c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解饱和食盐水的原理示意图如图所示。下列说法正确的是 ( )

A. M为负极
B. 通电使氯化钠发生电离
C. c出口收集到的物质是氯气
D. 电解一段时间后,阴极区pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在2L密闭容器中,起始投入4 molN2和6molH2在一定条件下生成NH3,平衡时仅改变温度测得的数据如表所示(已知:T1<T2)
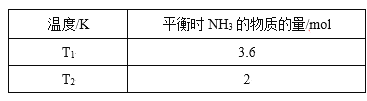
①则K1______K2,(填“>”、“<”或“=”)原因:_______。
②在T2下,经过10s达到化学平衡状态,则0~10s内N2的平均速率v(N2)为______,平衡时H2的转化率为______。若再同时增加各物质的量为1 mol,该反应的平衡V正_____V逆,(>或=或<)平衡常数将_____(填“增大”、“减小”或“不变”)
③下列能说明该反应已达到平衡状态的是___。
A.3v(H2)正=2v(NH3)逆 B.容器内气体压强不变
C.混合气体的平均相对分子质量不再改变的状态 D.△H保持不变
(2)已知下列化学键的键能写出工业上制氨的热化学方程式:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | 430 | 936 | 390 |
热化学方程式:__________。
(3)下列是科研小组设计的一个氮氧化物原电池,两边的阴影部分为a,b惰性电极,分别用导线与烧杯的m,n(惰性电极)相连接,工作原理示意图如图:
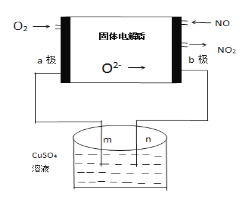
①a为___极,b极的电极反应式____________。
②在标准状况下,通入112mL的O2,可观察到烧杯中n处有_____生成,(假设烧杯中的溶液的体积为200mL,体积不变)最后反应终止时烧杯中溶液的PH为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol·L-1 NaOH溶液滴定10 mL 0.1 mol·L-1 H2X溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法不正确的是

A.水电离出来的c(OH-):D点>B点
B.C点存在关系式:c(Na+)=c(HX-)+c(X2-)-c(H+)
C.B点:c(HX-)>c(H+)>c(X2-)>c(H2X)
D.A点溶液中加入少量水:![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”简化表示。CH3—CH=CH-CH3可简写为 ![]() 。有机物X的键线式为:
。有机物X的键线式为:

(1)有机物X的分子式___________________
(2)有机物Y是X的同分异构体,属于芳香烃,写出Y的结构简式 _______________________________________________________
(3)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有_________种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com