
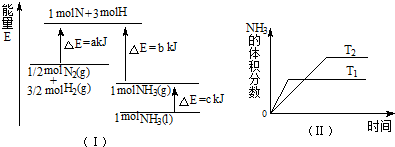
A���÷�Ӧ���Ȼ�ѧ����ʽ��
| ||||
| B���÷�Ӧ���Ȼ�ѧ����ʽ��N2��g��+3H2��g��=2NH3��1������H=2��a-b-c��kJ?mol-1 | ||||
| C�������������䣬�����¶ȣ������淴Ӧ���ʾ�������H2��ת�������� | ||||
| D��Tl��T2��������ӦΪ���ȷ�Ӧ�� |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |


 ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| W | X | Y | ||
| R | Z |
| t/s | 0 | 50 | 150 | 250 | 350 |
| n��PCl3��/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�������и߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
�������������ʡ����ᡢ����ȵ���Ҫԭ�ϡ�
��1��ʵ����ģ��ϳɰ����ں��º����ܱ������а��ռס��ҡ������ַ�ʽ�ֱ�Ͷ�ϣ���λ��mol /L����ƽ��ʱ��ü�������H2��ת����Ϊ20%��
|
|
N2 |
H2 |
NH3 |
|
�� |
1 |
3 |
0 |
|
�� |
0.5 |
1.5 |
1 |
|
�� |
0 |
0 |
4 |
��ƽ��ʱ�������а�����Ũ��Ϊ ��
���������п�ʼ��Ӧʱ��v�� v��(�������)��
�۴�ƽ��ʱ���ס��ҡ�����������NH3����������ɴ�С��˳��Ϊ ��
��2����ҵ����NH3��CO2Ϊԭ�Ϻϳ�����[CO(NH2)2]����Ӧ�Ļ�ѧ����ʽΪ��
2NH3 (g)+ CO2 (g)  CO(NH2)2
(l) + H2O (l)���÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ���£�
CO(NH2)2
(l) + H2O (l)���÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ���£�
|
T / �� |
165 |
175 |
185 |
195 |
|
K |
111.9 |
74.1 |
50.6 |
34.8 |
���ʱ䦤H_____0�����������������������
����һ���¶Ⱥ�ѹǿ�£���ԭ�����е�NH3��CO2�����ʵ���֮�ȣ���̼�ȣ� ��x����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ���� ��
��x����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ���� ��

����ͼ�е�B�㴦��NH3��ƽ��ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��㶫ʡ��ɽ���Ϻ���������ǰ������ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
��֪����KI�����ᡢ�Լ�X�͵���������Һ��ϣ���Ӧ������
�������еμ�˫��ˮ��������Ӧ��H2O2+2H++2I�� =2H2O+I2��
�����ɵ�I2�������Լ�X��Ӧ�����Լ�X����������ɵ� I2 �Ż������۱�����ˣ������Լ�X����������˫��ˮ����Һ���������ʱ�䣬�������㣺H2O2+2H++2I�� = 2H2O+I2�ķ�Ӧ���ʡ�
�±�Ϊijͬѧ��������ԭ����Ƶ�ʵ�鼰ʵ���¼����ʵ��������������½��У���
|
��� |
���ձ��м�����Լ�����������mL�� |
���� |
��ʼ����ʱ�䣨min�� |
||||
|
0��1 mol��L��1 KI��Һ |
H2O |
0��01 mol��L��1 X ��Һ |
0��1mol��L��1 ˫��ˮ |
1 mol��L1 ϡ���� |
|||
|
1 |
20��0 |
10��0 |
10��0 |
20��0 |
20��0 |
�� |
1��4 |
|
2 |
20��0 |
m |
10��0 |
10��0 |
n |
�� |
2��8 |
|
3 |
10��0 |
20��0 |
10��0 |
20��0 |
20��0 |
�� |
2��8 |
|
4 |
20��0 |
10��0 |
10��0 |
20��0 |
20��0 |
5��Fe2(SO4)3 |
0��6 |
��1����֪��ʵ��1��2��Ŀ����̽��H2O2Ũ�ȶ�H2O2+2H++2I�� = 2H2O+I2��Ӧ���ʵ�Ӱ�졣ʵ��2��m= ��n= ��
��2����֪��I2��X��ȫ��Ӧʱ���������ʵ���֮��Ϊ1��2���������е�X��KI�ļ�����������V��H2O2��>________����ȷ��������ɫ��
��3��ʵ��1��Ũ��c(X)�� t�ı仯������ͼ�������������������䣬���ڴ������ͼ�У��ֱ�ʵ��3��ʵ��4��c(X) �� t�ı仯����ͼ��������Ӧ�ı�ע����

��4��ʵ��4����������������߷�Ӧ���ʡ������ܼӿ췴Ӧ��������Ϊ���� (���ߡ����͡�)�˷�Ӧ��ܡ�
��5�������Ѻ����������������Ƴɹ�����֪����ܷ�ӦΪ��2Al(s)+3I2(s) 2AlI3(s)����I�������л�����ϳ�����Ϊ����ʣ��õ�ظ����ĵ缫��ӦΪ��________________________�����ʱAl���ӵ�Դ��___________����
2AlI3(s)����I�������л�����ϳ�����Ϊ����ʣ��õ�ظ����ĵ缫��ӦΪ��________________________�����ʱAl���ӵ�Դ��___________����
��6����֪��N2H4(l) +2H2O2(l)= N2(g)+4H2O(g) ��H1= ��640kJ/mol
H2O��l��=H2O��g�� ��H2��+44.0kJ/mol
��0.25mol Һ̬����Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų��������� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com