
����Ŀ���й��Ը߷�����Ϊ�²����ڸ��������еõ��㷺Ӧ�á��й�߷���F��һ�ֺϳ�·������:

��֪:
A����Է�������Ϊ60����Ԫ�ص���������Ϊ0.533���˴Ź���������ʾΪ����壬�������Ϊ1��3��
�ش���������:
(1)A�Ľṹ��ʽΪ____________��D�Ļ�ѧ������____________��
(2)�١��ڵķ�Ӧ���ͷֱ���____________��____________��
(3)��Ӧ�۵Ļ�ѧ����ʽ��_____________��
(4)F�еĹ�������______________(�����������)��
(5)�����廯����G��E��ͬ���칹�壬�ܷ���������Ӧ�ҷ�����ֻ��4�ֲ�ͬ��ѧ�������⡣д������G�Ľṹ��ʽ:______________��
(6)д���Լױ�Ϊԭ��(�������Լ���ѡ)�Ʊ�������D�ĺϳ�·�ߣ���ͷ�Ϸ����Լ����·�����������
__________
���𰸡� CH3COOH ����ȩ �ӳɷ�Ӧ �Ӿ۷�Ӧ 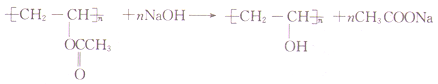 ̼̼˫��������
̼̼˫�������� 
��������A����Է�������Ϊ60����Ԫ�ص���������Ϊ0.533����A��������������ԭ����=![]() =2����Ϸ�Ӧ���Ʋ�A����Ϊ���ᣬ���ɺ˴Ź���������ʾΪ����塢�������Ϊ1��3��ȷ��AΪ���ᡣ��Ӧ��Ϊ�ӳɷ�Ӧ����Ϸ�Ӧ��������E��F�Ľṹ�������Ƴ���Ӧ��Ϊ�Ӿ۷�Ӧ��BΪ��������ϩ������Ӧ��Ϊ����ˮ�ⷴӦ��CΪ����ϩ����
=2����Ϸ�Ӧ���Ʋ�A����Ϊ���ᣬ���ɺ˴Ź���������ʾΪ����塢�������Ϊ1��3��ȷ��AΪ���ᡣ��Ӧ��Ϊ�ӳɷ�Ӧ����Ϸ�Ӧ��������E��F�Ľṹ�������Ƴ���Ӧ��Ϊ�Ӿ۷�Ӧ��BΪ��������ϩ������Ӧ��Ϊ����ˮ�ⷴӦ��CΪ����ϩ����
(1)A�Ľṹ��ʽΪCH3COOH��D�Ļ�ѧ�����DZ���ȩ��
(2)�١��ڵķ�Ӧ���ͷֱ��Ǽӳɷ�Ӧ���Ӿ۷�Ӧ��
(3)��Ӧ�۵Ļ�ѧ����ʽ��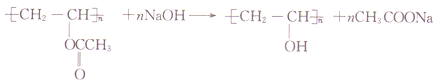 ��
��
(4)F�еĹ�������̼̼˫����������
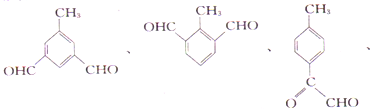
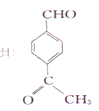
(5)�����廯����G��E��ͬ���칹�壬�ܷ���������Ӧ�ҷ�����ֻ��4�ֲ�ͬ��ѧ�������⡣G�Ŀ��ܵĽṹ��ʽ�� 
 ��
��
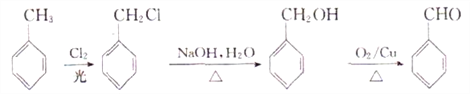
(6)�Լױ�Ϊԭ�ϣ������������ڹ��յ������£����в����ϵ�һ��ȡ����Ȼ�����ɵ��ȴ����ڼ���������ˮ�����ɱ��״������ѱ��״������õ�����ȩ������ϳ�·�����£� 



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��Ԫ������Ȼ����ḻ��Ԫ�أ��ڻ�ѧ���к���Ҫ�ĵ�λ���ش��������⣺
��1����̬��ԭ�ӵļ۲���ӹ������ʽΪ_______________________���ڶ����ڵ�Ԫ���У���һ�����ܱȵ�Ԫ�صĵ�һ������С��Ԫ�ع���__________�֡�
��2��Ԥ����2017�귢��ġ��϶���š�̽�������õij���������ػ��ȼ��Ϊƫ������[(CH3)2NNH2]��
(CIUXNH����N��ԭ�ӵ��ӻ���ʽΪ__________��
��3�����ü۲���ӻ������۽���NH3�����幹��Ϊ�����ε�ԭ��__________________________����NH3��Ϊ�ȵ����������Ϊ__________���ѧʽ����һ�����ɣ���
��4����CuSO4��Һ�мӹ�����ˮ���������Һ�м���һ�����Ҵ�������[Cu(NH3)4]SO4��H2O����Ҫȷ��[Cu(NH3)4]SO4��H2O�Ǿ��廹�ǷǾ��壬���ѧ�ķ����Ƕ������_______________________ʵ�顣lmol [Cu(NH3)4]2-���еĦҼ�����ĿΪ__________��
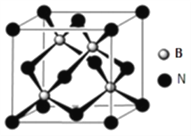
��5�����������������ɻ���У��侧����ͼ��ʾ�����ھ��������ϵ�ԭ�ӵ���λ��Ϊ__________����������������ܶ�Ϊ�� g/cm3���������Ħ������ΪM������٤������ΪNA�������ԭ�ӵİ뾶Ϊr pm������ԭ�ӵĿռ�������Ϊ__________�����ú��Цѡ�M��NA��r��ʽ�ӱ�ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����(����)
A������������������ɢϵ�ĸ���ԭ���ǽ����ж��������
B����ɢϵ�з�ɢ������ֱ����С�������ȷ˳���ǣ���Һ<����<��Һ
C������ͨ���������Һʱ�����Կ���һ��������ͨ·������Һ����
D������ķ�ɢ�ʿ���ͨ�����˴ӷ�ɢ���з������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС��Ϊ���˽�HCl��NaHSO4��NaHCO3��ˮ��Һ�еĵ����������������ʵ�飺
�ٷֱ�ⶨ��0.1 mol��L��1��HCl��NaHSO4��NaHCO3 ��Һ��H�������ʵ���Ũ�ȣ�HCl��Һ ��c(H��)��0.1 mol��L��1��NaHSO4��Һ��c(H��)��0.1 mol��L��1����NaHCO3��Һ��H������ �ʵ���Ũ��ԶԶС��0.1 mol��L��1��
��ȡ����NaHSO4��Һ���Թ��У�����BaCl2��Һ�в�����ϡ����İ�ɫ�������ɡ�
��ȡ����NaHCO3��Һ���Թ��У����뼸��BaCl2��Һ����������
�����ʵ�����ش��������⣺
��1���ֱ�д��HCl��NaHSO4��NaHCO3��ˮ��Һ�еĵ��뷽��ʽ��HCl��__________________________________________________��
NaHSO4��__________________________________________________��
NaHCO3��__________________________________________________��
��2��NaHSO4�����������������������е�________________________��
��3��д�����з�Ӧ�Ļ�ѧ����ʽ��_________________________________________________��
��4������NaHSO4��Ba(OH)2����Һ�а������ʵ���֮��1��1��ϣ���Ӧ�����ӷ���ʽΪ__________________________________________________________________________��
��5������NaHSO4��μ���Ba(OH)2��Һ����Ba2��ǡ����ȫ��������Ӧ�����ӷ���ʽΪ_________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
A. ������Ԫ���⣬������Ԫ�ص�����ϼ�����ֵ�϶����ڸ�Ԫ��������������
B. ���������⣬�������ھ���18��Ԫ��
C. ����Ԫ����û�зǽ���Ԫ��
D. �����Ԫ����ָIA�������Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ����Ȼ�ѧ����ʽΪ N2(g)+3H2(g)![]() 2NH3(g) ��H=92.4 kJ/mol���ֽ�l mol N2(g)��3 mol H2(g)����һ�ݻ�Ϊ2 L���ܱ������У���500���½��з�Ӧ��10 min ʱ�ﵽƽ�⣬NH3���������Ϊ
2NH3(g) ��H=92.4 kJ/mol���ֽ�l mol N2(g)��3 mol H2(g)����һ�ݻ�Ϊ2 L���ܱ������У���500���½��з�Ӧ��10 min ʱ�ﵽƽ�⣬NH3���������Ϊ![]() ������˵������ȷ����
������˵������ȷ����

A�����ﵽƽ��ʱ�������ϵ�ų�9.24 kJ��������H2��Ӧ���ʱ仯������ͼ����ʾ
B����Ӧ�����У��������ƽ����Է�������ΪM����������ܶ�Ϊd���������ѹǿΪp�����߹�ϵ��ͼ��
C����ͼ����ʾ������I��II�ﵽƽ��ʱ��NH3���������Ϊ![]() ��������I�ų�����������II��������֮��Ϊ92.4 kJ
��������I�ų�����������II��������֮��Ϊ92.4 kJ
D������ʼ��������Ϊ1 mol N2��3 mol H2���ڲ�ͬ�����´ﵽƽ��ʱ��NH3����������仯��ͼ����ʾ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����д�Ȼ�ѧ����ʽҪע�����ʵľۼ�״̬��ԭ����
A.����˵����Ӧ�����
B.���ʳ��ֵ�״̬�뷴Ӧ�ʱ��й�
C.˵����Ӧ����
D.���ʳ��ֵ�״̬������ʲô�����й�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�̪��NaOH��Һ�еμ���������Һ��Ϊ��ɫ���ù�������ϵpH�ı仯Ϊ(����)
A. ��С��� B. ��������С
C. �ɴ��С D. �ȱ�С������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ����ij�������R��Br���е���Ԫ�أ��������²�������ȡ������������ڼ���NaOH��Һ�ۼ��Ȣ���ȴ�������ݼ���AgNO3��Һ���ڢܲ���ȴ��IJ�����
A.����ϡHNO3�ữB.����ϡH2SO4�ữ
C.����ϡ�����ữD.����Ҫ����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com