
 MnCl2+Cl2↑+2H2O(MnO2不能氧化稀盐酸).用下列两种方法制取氯气:①用含HCl146g的浓盐酸与足量MnO2充分反应;②用87gMnO2与足量的浓盐酸充分反应.不考虑HCl 挥发,则两种方法生成的氯气的量的是方法①______(填“>”、“<”或“=”)方法②.
MnCl2+Cl2↑+2H2O(MnO2不能氧化稀盐酸).用下列两种方法制取氯气:①用含HCl146g的浓盐酸与足量MnO2充分反应;②用87gMnO2与足量的浓盐酸充分反应.不考虑HCl 挥发,则两种方法生成的氯气的量的是方法①______(填“>”、“<”或“=”)方法②. CuSO4+SO2↑+2H2O,被还原的浓硫酸为参加反应的浓硫酸的一半,随着反应的进行,浓硫酸变稀,铜与稀硫酸不反应,故参加反应的浓硫酸小于1.80mol,所以被还原的硫酸的物质的量小于0.900mol,故答案为:Cu+2H2SO4 (浓)
CuSO4+SO2↑+2H2O,被还原的浓硫酸为参加反应的浓硫酸的一半,随着反应的进行,浓硫酸变稀,铜与稀硫酸不反应,故参加反应的浓硫酸小于1.80mol,所以被还原的硫酸的物质的量小于0.900mol,故答案为:Cu+2H2SO4 (浓)  CuSO4+SO2↑+2H2O;<;
CuSO4+SO2↑+2H2O;<; ×2+n(NO)+n(NO2),得n(NO)+n(NO2)=0.4mol,体积为8.96L;
×2+n(NO)+n(NO2),得n(NO)+n(NO2)=0.4mol,体积为8.96L;

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| ||
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河北省唐山市高一(上)期末化学试卷(解析版) 题型:解答题
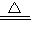 MnCl2+Cl2↑+2H2O(MnO2不能氧化稀盐酸).用下列两种方法制取氯气:①用含HCl146g的浓盐酸与足量MnO2充分反应;②用87gMnO2与足量的浓盐酸充分反应.不考虑HCl 挥发,则两种方法生成的氯气的量的是方法①______(填“>”、“<”或“=”)方法②.
MnCl2+Cl2↑+2H2O(MnO2不能氧化稀盐酸).用下列两种方法制取氯气:①用含HCl146g的浓盐酸与足量MnO2充分反应;②用87gMnO2与足量的浓盐酸充分反应.不考虑HCl 挥发,则两种方法生成的氯气的量的是方法①______(填“>”、“<”或“=”)方法②.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com