
【题目】钠有多种化合物,如氧化钠、过氧化钠、氢氧化钠、碳酸钠、碳酸氢钠等等,这些物质在实际生活中有广泛的应用,一定条件下相互间能进行转化。完成下列计算:
(1)将7.8 g Na2O2完全溶于93.8 g水中,所得溶液中溶质的质量分数为________。
(2)将11.6 g二氧化碳和水蒸气的混合物与足量的Na2O2充分反应,固体质量增加了3.6 g,则原混合气体的平均相对分子质量为________。
(3)向100 mL NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M(不含结晶水)。通入二氧化碳的体积V(标准状况下)与M的质量W的关系如下图所示。
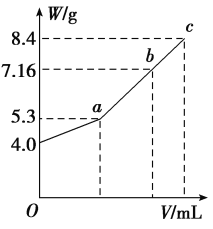
(a)推断b点时M的组成成分_____________________。(填化学式,下同)
(b)若向b点的盐溶液中只加入0.03 mol某钠的化合物,充分反应后,减压低温蒸发得到无水Na2CO3 8.48 g,则加入的物质可以是________或________。
(4)将31 g NaOH和NaHCO3的固体混合物,在密闭容器中加热到250 ℃,经充分反应后排出气体、冷却,称得剩余固体的质量为N g,试分析不同N值时,剩余固体的组成成分(已知NaHCO3的分解温度低于250 ℃)_______________ ________。
【答案】(1)8% (2)23.2 (3)Na2CO3、NaHCO3 Na2O Na2O2
(4)N>26.5时,剩余固体为NaOH和Na2CO3的混合物;N≤26.5时,剩余固体为Na2CO3
【解析】(1)过氧化钠与水反应:
2Na2O2+2H2O===4NaOH + O2↑
156 160 32
7.8 g m(NaOH) m(O2)
解得:m(NaOH)=8 g m(O2)=1.6 g
所得溶液中溶质的质量分数:![]() ×100%=8%。
×100%=8%。
(2)设二氧化碳、水蒸气的物质的量分别是x mol、y mol,则
![]() ,解得
,解得![]() ,所以原混合气体的物质的量为(0.1+0.4)mol=0.5 mol,原混合气体的平均摩尔质量为
,所以原混合气体的物质的量为(0.1+0.4)mol=0.5 mol,原混合气体的平均摩尔质量为![]() =23.2 g/mol。
=23.2 g/mol。
(3)由题图知NaOH质量为4.0 g,物质的量为0.1 mol,完全转化为Na2CO3时,Na2CO3质量为0.1×0.5 mol×106 g/mol=5.3 g,完全转化为NaHCO3时,NaHCO3质量为0.1 mol×84 g/mol=8.4 g,故a点白色固体M为Na2CO3,c点白色固体M为NaHCO3。
(a)b点时M的质量为7.16 g,5.3<7.16<8.4,则M由Na2CO3和NaHCO3组成。
(b)经计算得7.16 g盐中Na2CO3为0.02 mol,NaHCO3为0.06 mol。要得到纯净的8.48 g Na2CO3固体,即要将NaHCO3完全转变为Na2CO3,“则加入的物质”需满足3个条件:a.显碱性或能生成碱,b.含有钠元素,c.不能带来其他杂质。根据钠原子守恒,0.03 mol物质中需有0.06 mol钠原子,故符合条件的有Na2O、Na2O2。
(4)在密闭容器中加热到250 ℃时发生反应:①NaOH+NaHCO3![]() Na2CO3+H2O↑,若碳酸氢钠过量,还发生反应:②2NaHCO3
Na2CO3+H2O↑,若碳酸氢钠过量,还发生反应:②2NaHCO3![]() Na2CO3+CO2↑+H2O↑,若NaOH、NaHCO3恰好按1∶1反应,固体减少质量为水的质量,根据化学方程式可知,生成水的质量为31 g×
Na2CO3+CO2↑+H2O↑,若NaOH、NaHCO3恰好按1∶1反应,固体减少质量为水的质量,根据化学方程式可知,生成水的质量为31 g×![]() =4.5 g,实际固体质量减少(31-N)g,所以当(31-N)g<4.5 g,即N>26.5时说明氢氧化钠过量只发生反应①,最终所得固体为NaOH和Na2CO3的混合物;当(31-N)g>4.5 g,即N<26.5时说明碳酸氢钠过量,发生反应①和②,最终所得固体为Na2CO3;当(31-N)g=4.5 g,即N=26.5 g时只发生反应①,剩余固体为Na2CO3。
=4.5 g,实际固体质量减少(31-N)g,所以当(31-N)g<4.5 g,即N>26.5时说明氢氧化钠过量只发生反应①,最终所得固体为NaOH和Na2CO3的混合物;当(31-N)g>4.5 g,即N<26.5时说明碳酸氢钠过量,发生反应①和②,最终所得固体为Na2CO3;当(31-N)g=4.5 g,即N=26.5 g时只发生反应①,剩余固体为Na2CO3。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】25 ℃和1.01×105 Pa时,反应2N2O5(g)=4NO2(g)+O2(g) ΔH=+56.76 kJ/mol自发进行的原因是
A.是吸热反应 B.是放热反应
C.是熵减小的反应 D.熵增大效应大于能量效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铁粉与一定量的盐酸反应,为了减慢反应速率,但不减少氢气的产量,可加入下列物质中的
A. 水 B. NaOH固体 C. Na2CO3固体 D. NaNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.78 g Na2O2固体中含有的阴离子数为NA(相对原子质量Na:23 O:16)
B.标准状况下,11.2 L乙烯含有的共价键数目为3NA
C.在0 ℃、101 kPa时,金属钠从水中置换出22.4 L H2,发生转移的电子数为2NA
D.在25 ℃时,pH=13的NaOH溶液中含有的OH-数约为6.02×1022
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100℃时,pH=6,该温度下0.1molL-1的NaOH溶液中,溶液的pH= .
(2)25℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为 , 由水电离出的c(OH-)= mol·L-1.
(3)体积均为100mL、pH均为2的盐酸与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX是 (填“强酸”或“弱酸”),理由是 .
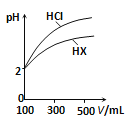
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含amol氢氧化钠的溶液加热,恰好使NH4+完全转化为NH3逸出,另取一份加入含bmolHCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A. (2b-a)mol/L B. (10b-5a)mol/L C. (![]() )mol/L D. (
)mol/L D. ( ![]() ) mol/L
) mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com