


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
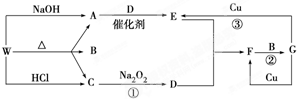
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)氢气是一种新型的绿色能源,又是一种重要的化工原料.氢气燃烧热值高.实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出 142.9kJ 热量.则能表示H2标准燃烧热的热化学方程式为
(1)氢气是一种新型的绿色能源,又是一种重要的化工原料.氢气燃烧热值高.实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出 142.9kJ 热量.则能表示H2标准燃烧热的热化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用带火星的木条鉴别空气和氧气 |
| B、用可见光束照射以区别溶液和胶体 |
| C、用熟石灰粉末与之混合、研磨,鉴别硫酸铵和氯化铵两种化肥 |
| D、用燃烧的方法鉴别羊毛和合成纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在c(H+)/c(OH-)=1×10-14的溶液中:NH4+、Ca2+、Cl-、K+ |
| B、水电离的c(H+)=10-13mol?L-1的溶液中:Fe3+、SO42-、K+、SCN- |
| C、在c(H+)=10-14mol/L的溶液中可能含:Na+,AlO22-,CO32-,SO32- |
| D、c(OH-)=1×10-14mol/L的溶液中:Na+、K+、Cl-、S2O32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com