
| A、少量CO2通入Ba(OH)2溶液中:CO2+2OH-═CO32-+H2O |
| B、NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:NH4++Al3++2SO42-+2Ba2++4OH-═NH3?H2O+Al(OH)3↓+2BaSO4↓ |
| C、FeCl3溶液腐蚀铜线路板:Fe3++Cu═Fe2++Cu2+ |
| D、向NaHCO3溶液中滴入少量Ca(OH)2溶液:HCO3-+OH-═CO32-+H2O |


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
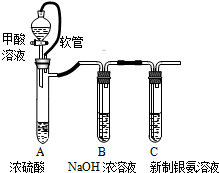 | 已知:银氨溶液制备反应为 Ag++2NH3?H2O═[Ag(NH3)2]++2H2O. 反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 部分短周期元素的原子半径及主要化合价 | ||||||
| 元素代号 | G | L | M | Q | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +5、-3 | -2 |
| A、GOH溶液和M(OH)3可以相互反应 |
| B、非金属性:T<Q |
| C、气态氢化物的稳定性:R>T |
| D、L2+与T2-核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲苯的硝化反应生成三硝基甲苯 |
| B、甲苯能使酸性高锰酸钾溶液褪色 |
| C、甲苯燃烧产生带浓烟的火焰 |
| D、1mol甲苯与3mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
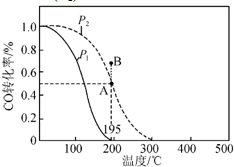 在20L的密闭容器中按物质的量之比1:2充入CO和H2,发生:CO(g)+2H2(g)?CH3OH(g);△H.测得CO的转化率随温度及不同压强下CO的变化如图所示,P2和195℃时n(H2)随时间的变化结果如表所示.下列说法正确的是( )
在20L的密闭容器中按物质的量之比1:2充入CO和H2,发生:CO(g)+2H2(g)?CH3OH(g);△H.测得CO的转化率随温度及不同压强下CO的变化如图所示,P2和195℃时n(H2)随时间的变化结果如表所示.下列说法正确的是( )| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
| A、P1<P2,△H<0 |
| B、0~3 min,平均速率v(CH3OH)=0.8 mol?L-1?min-1 |
| C、在P2及195℃时,该反应的平衡常数为25 L2?mol-2 |
| D、在B点时,v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SiO2具有较好的导电性,可用于制造半导体材料 |
| B、H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 |
| C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D、Mg在空气中燃烧发出耀眼的白光,可用于制作信号弹 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述燃料电池的负极反应材料是氢气、甲烷、乙醇等物质 |
| B、氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇航员使用 |
| C、乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e-═2CO2↑+3H2O |
| D、KOH作电解质的甲烷燃料电池的正极反应为O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、流水、风力是一次能源,电力、蒸汽是二次能源 |
| B、普通锌锰电池是一次电池,碱性锌锰电池是二次电池 |
| C、同周期元素形成的简单离子中,原子序数越大的离子半径越小 |
| D、原子核外电子层数越多,原子半径一定越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
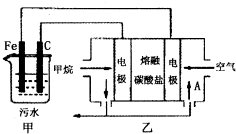 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )| A、为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 |
| B、甲装置中Fe电极的反应为Fe-3e-=Fe3+ |
| C、为了增加污水的导电能力,应向污水中如入适量的H2SO4溶液 |
| D、当乙装置中有1.6g CH4参加反应,则C电极理论上生成气体在标准状况下为4.48L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com