
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+ 的核外电子排布式是 。
(2)向ZSO4溶液中逐滴滴入R的氢化物的水溶液至过量,用离子方程式表示该过程的变化:
(3)在下图中画出[Z(NH3)4]2+离子中,Z2+与NH3分子形成的配位键。
(4)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(5)Q、R、Y三种元素的第一电离能数值由大到小的顺序为 (用元素符号作答)
(6)Q的一种氢化物相对分子质量为28,其中分子中的σ键与π键的键数之比为 。
(10分)(1)1s22s22p63s23p63d9 (2分)
(2)Cu2+ + 2NH3·H2O = Cu(OH)2↓ + 2NH4+;(2分)Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH-
(或Cu(OH)2 + 4NH3·H2O =[Cu(NH3)4]2+ + 2OH- + 4H2O);(2分)
⑶ 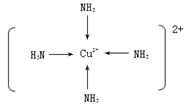 (4)b (5)N ﹥C﹥Si (5) 5:1
(4)b (5)N ﹥C﹥Si (5) 5:1
解析试题分析:Z的原子序数为29,则Z应该是铜元素。Q、X原子p轨道的电子数分别为2和4,则Q是碳元素,X是氧元素。Y原子价电子(外围电子)排布msnmpn ,这说明n=2。且Y的原子序数氧元素的,所以Y是硅元素。R原子核外L层电子数为奇数,且R的原子序数小于氧元素,大于碳元素的,所以R是氮元素。
(1)根据构造原理可知,Z2+ 的核外电子排布式是1s22s22p63s23p63d9。
(2)氨气能和铜离子形成配位健,所以反应的离子方程式是Cu2+ + 2NH3·H2O = Cu(OH)2↓ + 2NH4+、 Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH-(或Cu(OH)2 + 4NH3·H2O =[Cu(NH3)4]2+ + 2OH- + 4H2O);。
(3)在该配位化合物中氨气提供孤对电子,是配体,铜离子接受孤对电子,因此结构简式为(见答案)。
(4)碳元素的非金属性强于硅元素的,所以甲烷的稳定性强,甲烷由于相对分子质量小于硅甲烷的,所以沸点是硅甲烷的高,答案选b。
(5)非金属性压强,第一电离能越大,则第一电离能大小顺序是N ﹥C﹥Si。
(6)Q的一种氢化物相对分子质量为28,则该化合物是乙烯。乙烯含有碳碳双键,而单键都是σ键,双键是由1个σ键和1个π键构成的,所以其中分子中的σ键与π键的键数之比为5:1。
考点:考查核外电子排布、配位健、氢化物稳定性、第一电离能以及共价键的判断和有关计算
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查。试题综合性强,难易适中,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理和规范答题能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com