
 的物质,该物质是一种香料.
的物质,该物质是一种香料.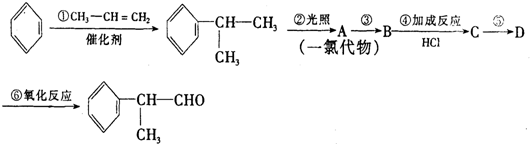
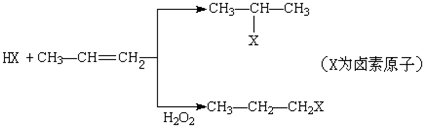
 ,
, .
.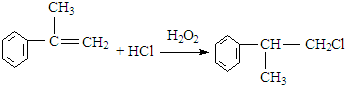 .反应⑤的化学方程式为(有机物写结构简式,并注明反应条件):
.反应⑤的化学方程式为(有机物写结构简式,并注明反应条件): +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$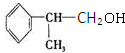 +NaCl.
+NaCl.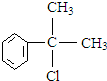 的水解产物
的水解产物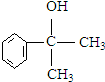 不能经氧化反应⑥而得到产品,导致产率低.
不能经氧化反应⑥而得到产品,导致产率低. ,
, ,
, .
. 分析 苯与丙烯发生加成反应生成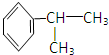 ,
, 在光照条件下生成一氯代物A,应是发生取代反应,A转化得到B,B与HCl发生加成反应生成C,则C为卤代烃,故A转化为B应是在氢氧化钠醇溶液、加热条件下发生消去反应,D发生氧化反应生成
在光照条件下生成一氯代物A,应是发生取代反应,A转化得到B,B与HCl发生加成反应生成C,则C为卤代烃,故A转化为B应是在氢氧化钠醇溶液、加热条件下发生消去反应,D发生氧化反应生成 ,则D为
,则D为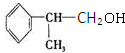 ,C在氢氧化钠水溶液、加热条件下发生水解反应生成D,故C为
,C在氢氧化钠水溶液、加热条件下发生水解反应生成D,故C为 ,B为
,B为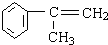 ,A为
,A为 或
或 ,据此解答.
,据此解答.
解答 解:苯与丙烯发生加成反应生成 ,
, 在光照条件下生成一氯代物A,应是发生取代反应,A转化得到B,B与HCl发生加成反应生成C,则C为卤代烃,故A转化为B应是在氢氧化钠醇溶液、加热条件下发生消去反应,D发生氧化反应生成
在光照条件下生成一氯代物A,应是发生取代反应,A转化得到B,B与HCl发生加成反应生成C,则C为卤代烃,故A转化为B应是在氢氧化钠醇溶液、加热条件下发生消去反应,D发生氧化反应生成 ,则D为
,则D为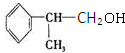 ,C在氢氧化钠水溶液、加热条件下发生水解反应生成D,故C为
,C在氢氧化钠水溶液、加热条件下发生水解反应生成D,故C为 ,B为
,B为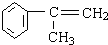 ,A为
,A为 或
或 .
.
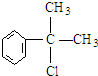
(1)A的结构简式可能为: 、
、 ,
,
故答案为: 、
、 ;
;
(2)反应①属于加成反应,反应⑤属于取代反应,
故答案为:加成反应;取代反应;
(3)反应④的化学方程式为: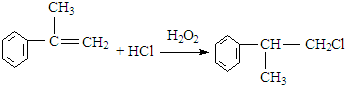 等,
等,
反应⑤的化学方程式为: +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$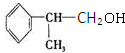 +NaCl,
+NaCl,
故答案为: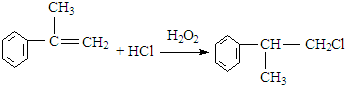 ;
; +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$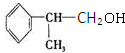 +NaCl;
+NaCl;
(4) 的水解产物
的水解产物 不能经氧化反应⑥而得到产品,导致产率低,故不采取将A直接转化为D的方法,
不能经氧化反应⑥而得到产品,导致产率低,故不采取将A直接转化为D的方法,
故答案为: 的水解产物
的水解产物 不能经氧化反应⑥而得到产品,导致产率低;
不能经氧化反应⑥而得到产品,导致产率低;
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色,说明含有酚羟基,②分子中有苯环,且苯环上的一溴代物有两种,可以是含有2个不同的取代基处于对位,符合上述条件的物质可能的结构简式: 、
、 、
、 或
或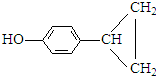 ,
,
故答案为: 、
、 、
、 等.
等.
点评 本题考查有机物推断、有机反应类型、同分异构体、有机方程式书写,难度中等,注意根据有机物的结构进行推断,需要学生熟练掌握官能团的性质与转化.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| A. | 该元素基态原子核外共有7种运动状态不同的电子 | |
| B. | 该元素位于周期表的S 区,属于金属元素 | |
| C. | 该元素在周期表中的位置第四周期第VA族 | |
| D. | 该元素M层含有11个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(N2)正=v(NH3)逆 | |
| B. | 单位时间内3molH-H键断裂,同时6molN-H键断裂 | |
| C. | n(N2):n(H2):(NH3)=1:3:2 | |
| D. | 混合气体的密度不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在共价化合物中不可能含有离子键 | |
| B. | 阴阳离子之间通过静电引力形成的化学键,叫共价键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 含有离子键的化合物不一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水中当加入硝酸银溶液后,溶液颜色变浅 | |
| B. | 高压比常压有利于工业合成氨反应 | |
| C. | 红棕色NO2加压后颜色比原来要深 | |
| D. | 热的纯碱除油污效果好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| I | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| II | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| III | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com