
【题目】某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(图中铁架台等夹持仪器均已略去):
Ⅰ、实验装置如图所示
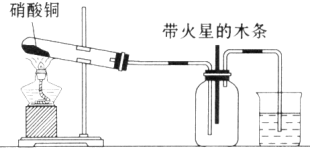
⑴硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气。写出该反应的化学方程式: 。
⑵当集气瓶中充满红棕色气体时,木条复燃。有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确”),理由是 。
Ⅱ、实验装置如图所示
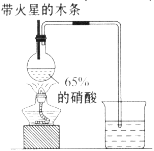
⑴写出浓硝酸受热分解的化学方程式: 。
⑵实验开始后木条上的火星逐渐熄灭,有的同学提出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确”),理由是 。
【答案】
Ⅰ. ⑴2Cu(NO3)2![]() 2CuO+4NO2↑+O2↑;⑵正确;Cu(NO3)2分解产生的O2的体积分数与空气中O2的体积分数相等,但空气不能使带火星的木条复燃,所以NO2能支持燃烧。
2CuO+4NO2↑+O2↑;⑵正确;Cu(NO3)2分解产生的O2的体积分数与空气中O2的体积分数相等,但空气不能使带火星的木条复燃,所以NO2能支持燃烧。
Ⅱ. ⑴4HNO3(浓)![]() 4NO2↑+O2↑+2H2O;⑵不正确;可能是由于产生大量的水蒸汽所致。
4NO2↑+O2↑+2H2O;⑵不正确;可能是由于产生大量的水蒸汽所致。
【解析】
试题分析:Ⅰ.(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,所以该反应的化学方程式是2Cu(NO3)2![]() 2CuO+4NO2↑+O2↑,故答案为:2Cu(NO3)2
2CuO+4NO2↑+O2↑,故答案为:2Cu(NO3)2![]() 2CuO+4NO2↑+O2↑;
2CuO+4NO2↑+O2↑;
(2)2Cu(NO3)2![]() 2CuO+4NO2↑+O2↑,该反应中氧气占总气体体积的 四分之一.与空气中氧气的体积分数基本相同,若NO2不支持燃烧,则木条不会复燃,根据实验现象知,二氧化氮支持燃烧,故正确,故答案为:正确;硝酸铜分解产生的混合气体中氧气的体积分数与空气中氧气的体积分数基本相同,若NO2不支持燃烧,则木条不会复燃;
2CuO+4NO2↑+O2↑,该反应中氧气占总气体体积的 四分之一.与空气中氧气的体积分数基本相同,若NO2不支持燃烧,则木条不会复燃,根据实验现象知,二氧化氮支持燃烧,故正确,故答案为:正确;硝酸铜分解产生的混合气体中氧气的体积分数与空气中氧气的体积分数基本相同,若NO2不支持燃烧,则木条不会复燃;
Ⅱ.(1)浓硝酸具有强挥发性,且不稳定,在加热条件下能分解生成二氧化氮、氧气和水,4HNO3(浓)![]() 4NO2↑+O2↑+2H2O,故答案为:4HNO3(浓)
4NO2↑+O2↑+2H2O,故答案为:4HNO3(浓)![]() 4NO2↑+O2↑+2H2O;
4NO2↑+O2↑+2H2O;
(2)该反应的反应条件是加热,加热过程中有水蒸气生成,产生的大量水蒸气抑制了NO2的助燃,导致NO2不能支持木条的燃烧的假象,所以不正确,故答案为:不正确;带火星的木条熄灭可能是由于加热时产生大量水蒸气。


科目:高中化学 来源: 题型:
【题目】已知下列两个热化学方程式:
H2(g)+![]() O2(g)=H2O(l) ΔH=-285 kJ/mol
O2(g)=H2O(l) ΔH=-285 kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2220.0 kJ/mol
(1)实验测得H2和C3H8的混合气体共3 mol完全燃烧生成液态水时放热2790 kJ,则混合气体中H2和C3H8的体积比为____________。
(2)已知:H2O(l)=H2O(g) ΔH=+44.0 kJ/mol,写出丙烷燃烧生成CO2和气态水的热化学方程式:_____________________________。
(3)从H+、Cu2+、Na+、SO![]() 、Cl-五种离子中选择适当的离子组成电解质,符合下列要求。
、Cl-五种离子中选择适当的离子组成电解质,符合下列要求。
①以石墨棒为电极,电解时电解质质量减小,水量不变,应选用的电解质是________;
②以石墨棒为电极,电解时电解质质量不变,水量减小,应选用的电解质是________:
③以石墨棒为阳极,铁棒为阴极,电解时电解质质量和水量都减小,应选用的电解质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离混合物的操作中正确的是( )
A.用分液的方法分离水和四氯化碳
B.用分液的方法分离植物油和汽油
C.用过滤的方法分离酒精和水
D.用过滤的方法分离四氯化碳和碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积恒定的密闭容器中,可逆反应A(s)+2B(g) ![]() C(g)+D(g)达到化学平衡状态,以下说法不正确的是( )
C(g)+D(g)达到化学平衡状态,以下说法不正确的是( )
A.v (B)正=2 v (C)逆 B.容器内每消耗1 molD,同时生成1molD
C.容器内气体的密度不变 D.向容器中加入少量A,平衡正向移动,K不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不正确的是
A. 用量筒量取25 mL蒸馏水 B. 用分液漏斗分离乙醇和水
C. 用烧杯溶解FeCl3试样 D. 用托盘天平称量NaCl固体5.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备

(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)下图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。

a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备

(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,NH3·H2O的电离平衡常数Kb=1.75×10-5。该温度下,用0.01mol·L-1盐酸滴定10mLamol·L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示。下列说法正确的是
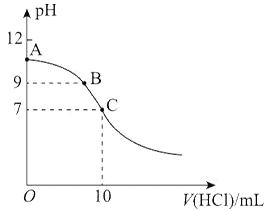
A. A点溶液中加少量水,![]() 减小
减小
B. 原氨水的物质的量浓度约为1.006×10-2mol·L-1
C. A、B、C三点溶液中水电离出来的c(OH-):A>B>C
D. C点时,盐酸和氨水恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 水分子间存在氢键,所以水分子比较稳定
B. H2SO4溶于水能电离出H+和SO42-,所以硫酸是离子化合物
C. I2加热升华过程中只需克服分子间作用力
D. SiO2熔化破坏共价键和分子间作用力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com