
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为___________________________
②利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式___________________________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1

测得CH3OH的物质的量随时间变化如上图所示,回答问题:
①下列措施中能使n(CH3OH)/n(CO2)增大的是________。
A.升高温度 B.充入He(g)使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1 mol CO2和3 mol H2
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“大于”“等于”或“小于”)。
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2、c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始时的 ,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
(3)用0.10 mol·L-1盐酸分别滴定20.00 mL 0.10 mol·L-1的NaOH溶液和20.00 mL 0.10 mol·L-1氨水所得的滴定曲线如下:

请指出盐酸滴定氨水的曲线为________(填“A”或“B”),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序________。
(1)①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-28.5 kJ·mol-1
②CO+4OH--2e-=CO32—+2H2O
(2)①CD
②大于
③0.4<c≤1
(3)B c(NH4+)>c(Cl-)>c(OH-)>c(H+)
【解析】(1)①根据盖斯定律,第一个方程式减去3乘以第二个方程式得Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=ΔH1-3ΔH2=489.0 kJ·mol-1-3×172.5 kJ·mol-1=-28.5 kJ·mol-1。②该燃料电池的总反应方程式为2CO+O2+4OH-=2CO32—+2H2O……①,电池正极反应式为O2+2H2O+4e-=4OH-……②,(①-②)÷2得负极反应式为CO+4OH--2e-=CO32—+2H2O。
(2)①A项,升高温度,平衡逆向移动,使比值减小;B项,恒容时充入不反应的气体,平衡不移动,比值不变;C项,将H2O(g)从体系中分离,平衡正向移动,使比值增大;D项,相当于增大压强,平衡正向移动,使比值增大。②曲线Ⅱ优先达到平衡且平衡时生成物CH3OH的物质的量小,说明曲线Ⅱ对应的温度高,升高温度放热反应的平衡常数减小。③甲、乙为等效平衡,甲起始时n(CO2)=1 mol,所以c≤1;利用三段式法可求得甲达到平衡时n(CH3OH)=n(H2O)=0.4 mol,要维持乙中反应起始时逆向进行,需使c>0.4。
(3)NH3·H2O是弱碱,浓度均为0.10 mol·L-1的NaOH溶液和氨水,氨水的pH小,故盐酸滴定氨水的曲线是B;a点pH>7,说明该点氨水过量,溶液中的溶质是NH4Cl和NH3·H2O,故溶液中离子浓度由大到小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+)


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:选择题
如图所示,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )


A.②①③④⑤⑥ B.⑤④②①③⑥
C.⑤④③①②⑥ D.⑤③②④①⑥
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷A(解析版) 题型:选择题
钢铁防腐方法有许多种,如图是其中的一种方法,描述正确的是( )
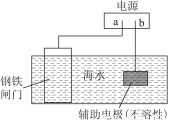
A.图中所示是牺牲阳极的阴极保护法
B.铁闸门作阴极,发生还原反应
C.电子流向:a→铁闸门→辅助电极→b
D.辅助电极上的反应:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:填空题
测定NaOH和Na2CO3的混合液中NaOH的含量时,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用已知浓度的盐酸滴定(用酚酞作指示剂,其变色pH范围为8~10)。试回答:
(1)滴定时BaCO3能否不断溶解?________(填“能” 或“不能”),理由是____________________________________________________。
(2)如用甲基橙作指示剂(其变色pH范围为3.1~4.4),则测定的结果________(填“偏高”“偏低”或“无影响”)。原因是_________________________________________________
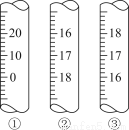
(3)上图是3种定量仪器的一部分,在酸碱中和滴定时应选________(填序号),在滴定接近终点时,应用蒸馏水润洗锥形瓶内壁,目的是________________________________________________________
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:选择题
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)??CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=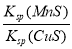
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:填空题
新的《环境空气质量标准》将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
(1)汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因________________________________________
(2)汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
则反应2NO(g)+2CO(g)??N2(g)+2CO2(g)的ΔH=________kJ·mol-1;该反应的ΔS________0(填“>”“<”或“=”)。
(3)将0.20 mol NO和0.10 mol CO充入一个容积恒定为1 L的密闭容器中,在不同条件下反应过程中部分物质的浓度变化状况如图所示。
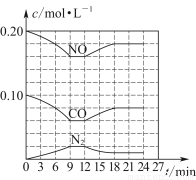
①计算产物N2在6~9 min时的平均反应速率v(N2)=________mol·L-1·min-1;
②第12 min时改变的反应条件为________(填“升温”或“降温”);
③计算反应在第24 min时的平衡常数K=________。若保持温度不变,再向容器中充入CO、N2各0.060 mol,平衡将________移动(填“正向”“逆向”或“不”)。
(4)环境监测中还可用沉淀法测定空气中含有较高浓度SO2的含量,经查得一些物质在20 ℃的数据如下表:
溶解度(S)/g | 溶度积(Ksp) | ||
Ca(OH)2 | Ba(OH)2 | CaSO3 | BaSO3 |
0.160 | 3.89 | 6.76×10-3 | 5.48×10-9 |
①吸收SO2最合适的试剂是________[填“Ca(OH)2”或“Ba(OH)2”]溶液;
②在20 ℃时,向CaSO3悬浊液中滴加适量的BaCl2溶液,当CaSO3向BaSO3的转化达到平衡时,溶液中的 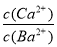 =____________(写出表达式即可)。
=____________(写出表达式即可)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:选择题
在容积为2 L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g),其他条件不变,在300 ℃和500 ℃时,甲醇物质的量n(CH3OH)?反应时间t的变化曲线如图所示,下列说法正确的是( )
CH3OH(g),其他条件不变,在300 ℃和500 ℃时,甲醇物质的量n(CH3OH)?反应时间t的变化曲线如图所示,下列说法正确的是( )
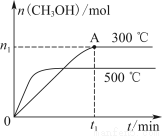
A.该反应的ΔH>0
B.其他条件不变,升高温度反应的平衡常数增大
C.300 ℃时,0~t1 min内 CH3OH的平均生成速率为 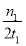 mol·L-1·min-1
mol·L-1·min-1
D.A点的反应体系从300 ℃升高到500 ℃,达到平衡时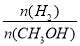 减小
减小
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:选择题
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。下列有关说法中,正确的是( )
A.N5+离子中含有36个电子 B.O2与O4属于同位素
C.C60硬度很大 D.H2与H3属于同素异形体
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题16物质结构与性质练习卷(解析版) 题型:填空题
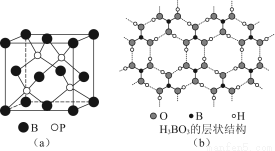
硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域。
(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为________,B原子的杂化类型为________。
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。图(a)是磷化硼晶体的晶胞示意图,则磷化硼的化学式为________,该晶体的晶体类型是________。
(3)正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连[如图(b)]。
①硼酸分子中B最外层有________个电子,1 mol H3BO3的晶体中有________mol氢键。
②硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+离子。则硼酸为________元酸,[B(OH)4]-含有的化学键类型为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com