
【题目】普通水泥在固化过程中自由水分子减少并形成碱性溶液。根据这个特点,科学家发明了测水泥初凝时间的某种方法。此法的原理如图所示,反应的总化学方程式为2Cu+Ag2O===Cu2O+2Ag,下列有关说法正确的是( )
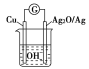
A. 工业上以石灰石和石英为主要原料制造普通水泥
B. 测定原理示意图中,Ag2O为负极
C. 负极的电极反应式为2Cu+2OH--2e-===Cu2O+H2O
D. 电池工作时,OH-向正极移动
科目:高中化学 来源: 题型:
【题目】欲将NaCl、CaCO3分离,可能会涉及如下操作步骤:
①溶解②过滤③蒸发结晶④洗涤⑤烘干⑥萃取,其中正确的是( )
A.①②③B.②③④⑤
C.①②③④⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A.平衡时,v正(O2)=v逆(O2)必成立
B.关系式5v正(O2)=4v正(NO)总成立
C.用上述四种物质NH3、O2、NO、H2O表示的正反应速率的数值中,v正(H2O)最小
D.若投入4 mol NH3和5 mol O2,通过控制外界条件,必能生成4 mol NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量;1 mol CH4 完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写中正确的是( )
A. CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=890.3 kJ·mol-1
B. CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890.3 kJ·mol-1
C. CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890.3 kJ
D. 2H2(g)+O2(g)===2H2O(l)ΔH=-517.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下列甲、乙、丙三图,判断下列叙述不正确的是( )
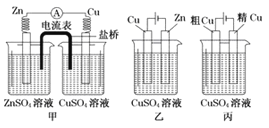
A. 甲是原电池,乙是电镀装置 B. 甲、乙装置中,锌极上均发生氧化反应
C. 乙、丙装置中,阳极均发生氧化反应而溶解 D. 丙装置中,铜电极的质量有增有减
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积一定的密闭容器中进行如下反应:X2(g)+2Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为a mol/L、b mol/L、 0.2mol/L(非平衡态),在一定条件下,当反应达到平衡时,Z的浓度为 0.3mol/L,则下列判断正确的是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为a mol/L、b mol/L、 0.2mol/L(非平衡态),在一定条件下,当反应达到平衡时,Z的浓度为 0.3mol/L,则下列判断正确的是( )
A. b≥0.1mol/L
B. 改变条件建立新平衡时Z的平衡浓度c:0.2mol/L≤c<0.3mol/L
C. a≥0.05 mol/L
D. 该平衡时气体物质的量浓度之和小于(a+b+0.2)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中的部分碘源于![]() 对海水中
对海水中![]() 的氧化。其科学小组进行
的氧化。其科学小组进行![]() 与含
与含![]() 溶液反应的相关研究:
溶液反应的相关研究:
(1)![]() 将
将![]() 氧化生成
氧化生成![]() 的过程由3步反应组成:
的过程由3步反应组成:
①![]()
![]()
②![]()
![]()
③![]()
![]()
用热化学方程式表示![]() 氧化
氧化![]() 生成
生成![]() 的反应______。
的反应______。
(2)![]() 在水中易分解,一定条件下,
在水中易分解,一定条件下, ![]() 的浓度减少一半时所需的时间(t)如下表所示。已知:
的浓度减少一半时所需的时间(t)如下表所示。已知: ![]() 的起始浓度为
的起始浓度为![]()
pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①![]() 增大能加速
增大能加速![]() 分解,表明对
分解,表明对![]() 分解起催化作用的是___________。
分解起催化作用的是___________。
②根据表中数据,推测![]() 在下列条件下分解速率依次增大的顺序为__________(填字母代号)
在下列条件下分解速率依次增大的顺序为__________(填字母代号)
a. 40℃、![]() b. 10℃、
b. 10℃、![]() c. 30℃、
c. 30℃、![]()
(3)![]() 在KI溶液中存在下列平衡:
在KI溶液中存在下列平衡:![]() 。测得不同温度下该反应的平衡常数如图所示,下列说法正确的是__________。
。测得不同温度下该反应的平衡常数如图所示,下列说法正确的是__________。

A. 反应![]() 的
的![]()
B. 利用该反应可以除去硫粉中少量的碘单质
C. 在上述平衡体系中加入苯,平衡不移动
D. 25℃时,在上述平衡体系中加入少量![]() 固体,平衡常数K小于680
固体,平衡常数K小于680
(4)将![]() 溶于
溶于![]() 中,得到紫红色的溶液,再加入一定浓度的
中,得到紫红色的溶液,再加入一定浓度的![]() 溶液,现象如图所示:
溶液,现象如图所示:

①上层溶液中含碘元素的微粒有_______________(用化学符号表示)。
②由实验现象可推测关于![]() 溶解性的结论是______________。
溶解性的结论是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com