
【题目】对H2O2的分解速率影响因素进行研究。在相同温度下,实验测得不同条件下出O2浓度随时间变化如图所示。下列说法不正确的是( )
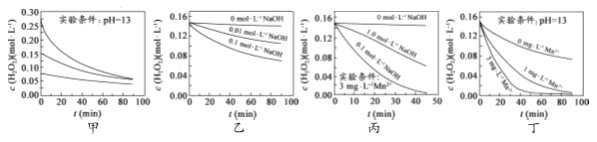
A. 图甲表明,可通过适当增大H2O2浓度,加快H2O2分解速率
B. 图乙表明,可通过调节溶液的酸碱性,控制H2O2分解速率快慢
C. 图丙表明,Mn2+少量存在时,碱性太强,不利于H2O2分解
D. 图乙、图丙和图丁表明,Mn2+是H2O2分解的催化剂,提高Mn2+的浓度就能增大H2O2 分解速率
【答案】D
【解析】A.图甲中溶液的pH相同,但浓度不同,浓度越大,相同时间内浓度的变化量越大,由此得出相同pH条件下,双氧水浓度越大,双氧水分解速率越快,故A正确;B.图乙中H2O2浓度相同,但加入NaOH浓度不同,说明溶液的pH不同,NaOH浓度越大,相同时间内双氧水浓度变化量越大,由此得出:双氧水浓度相同时,pH越大双氧水分解速率越快,故B正确;C.图丙中少量Mn2+存在时,相同时间内双氧水浓度变化量:0.1mol/LNaOH溶液>1.0mol/LNaOH溶液>0mol/LNaOH溶液,由此得出:锰离子作催化剂时受溶液pH的影响,但与溶液的pH值不成正比,碱性太强,不利于H2O2分解,故C正确;D.图丁中pH相同,锰离子浓度越大,相同时间内双氧水浓度变化量越大,但图丙中锰离子作催化剂时受溶液pH的影响,碱性太强,不利于H2O2分解,故D错误;故选D。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】下列物质中,既可与盐酸反应,又可与氢氧化钠溶液反应的是( )
①Na2SiO3 ②AlCl3 ③NH4HCO3 ④Al2O3 ⑤NaHSO4
A.③④ B.①④⑤
C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应且为放热反应的是( )
A. 氢氧化钾与硫酸的反应 B. 金属镁与盐酸的反应
C. 高温条件下碳粉与二氧化碳的反应 D. Ba(OH)2·8H2O晶体与NH4Cl固体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活密切相关,下列说法正确的是( )
A. 二氧化硫可广泛用于各类食品的漂白
B. 从海水提取任何物质都必须通过化学反应才能实现
C. 用热的纯碱溶液清除油圬
D. “地沟油”禁止食用,也不能用来制肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下图是由常见元素组成的一些单质及其化合物之间的转化关系图。A是由单质C在D中燃烧生成的淡黄色固体。B是最常见的无色液体,常温常压下,D、F、K均为无色无刺激性气味的气体。H和I焰色反应均为黄色。(反应中生成的部分物质已略去)

请回答下列问题:
(1)物质A的化学式为________。
(2)反应①的离子方程式为__________。
(3)反应②的化学方程式为_________。
(4)上述转化H→I的反应离子方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各对物质中,互为同系物的是
A. C2H4、C8H18 B. CH3CHO、C2H5OH C. C2H6、C4H10 D. CH3COOH、C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物中,可能含有下列离子中的几种:K+、NH4+、Mg2+、Ba2+、Cl-、SO42-、CO32-,将该混合物溶于水后得澄清溶液,现取三份各100 mL该溶液分别进行如下实验:
(1)在一份溶液中加入AgNO3溶液,有白色沉淀生成;
(2)在另一份溶液中加入足量的NaOH溶液并加热,收集到1.12 L气体(标准状 况下);
(3)在第三份溶液中加入足量的BaCl2溶液有沉淀生成,经称量其质量为8.6g,在该沉淀中加入足量的盐酸,沉淀部分溶解,剩余固体质量为4.66 g。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是_____________;
(2)溶液中一定存在的阴离子有___________,其物质的量浓度分别为___________,
(3)溶液中K+是否存在:_____________。若存在,它的物质的量的取值范围是 _____________。(若不存在,此空不需回答)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com