
 计算78.0gNa2O2的物质的量,根据方程式计算生成氧气的物质的量,再根据V=nVm计算体积.根据氧气的物质的量计算转移电子数目;
计算78.0gNa2O2的物质的量,根据方程式计算生成氧气的物质的量,再根据V=nVm计算体积.根据氧气的物质的量计算转移电子数目;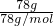 =1mol,根据方程式2Na2O2+2H2O=4NaOH+O2↑可知,生成氧气的物质的量为1mol×
=1mol,根据方程式2Na2O2+2H2O=4NaOH+O2↑可知,生成氧气的物质的量为1mol× =0.5mol,标况下氧气的体积为0.5mol×22.4L/mol=11.2L,反应中氧气为氧化产物,氧元素化合价由-1价升高为0价,故转移电子数目为0.5mol×2×6.02×1023mol-1=6.02×1023,故C正确;
=0.5mol,标况下氧气的体积为0.5mol×22.4L/mol=11.2L,反应中氧气为氧化产物,氧元素化合价由-1价升高为0价,故转移电子数目为0.5mol×2×6.02×1023mol-1=6.02×1023,故C正确; =1mol,溶于水配成1.00 L溶液,所得CuSO4溶液的浓度为1mol/L,体积1L为溶液的体积,不是溶剂的体积,故D错误;
=1mol,溶于水配成1.00 L溶液,所得CuSO4溶液的浓度为1mol/L,体积1L为溶液的体积,不是溶剂的体积,故D错误;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol?L-1,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述中不正确的是( )
如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol?L-1,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述中不正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第ⅠA族的金属元素是同一周期中金属性最强的元素 | B、P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 | C、元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | D、主族元素原子的最外层电子数不一定等于该元素的最高化合价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com