
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N(g)+3H2(g) 2NH3(g),在20℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是()
2NH3(g),在20℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是()

A.点a的正反应速率比b 的小
B.点c处反应达到平衡
C.点d(t2时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,该反应在25℃下反应达到平衡状态,所用的时间比原来的少
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:2015-2016学年广东省高二下期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和
D.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三5月模拟考试理综化学试卷(解析版) 题型:简答题
[化学-选修2:化学与技术]碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料。请根据题意回答下列问题:
Ⅰ.世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法。其流程如下:

(1)流程I的另一产物是____,流程Ⅱ的反应分步进行:a. 
b.Na2S与石灰石发生复分解反应,总反应方程式可表示为__________________。
Ⅱ.1862年,比利时人索尔维(ErnestSolvay)用氨碱法生产碳酸钠。反应原理如下:

20℃时一些物质在水中的溶解度/g•(100gH2O)

(2)氨碱法生成纯碱的原料是____________,可循环利用的物质有____________。
(3)饱和NaCl溶液通NH3和CO2能生成NaHCO3的原因有:_________、__________、_________。
Ⅲ.我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原
料利用率。

(4)生产中需向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在________(填温度范围)下析出________(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏六盘山高中高三第四次模拟理综化学试卷(解析版) 题型:选择题
下列各溶液中,微粒的物质的量浓度关系表述正确的是
A.0.1 mol·L-1 Na2CO3溶液中:c(Na+)=c(HCO3—)+c(H2CO3)+2c(CO32—)
B.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等
C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸溶液等体积混合所得碱性溶液中
c(Na+)+c(H+)=c(A-)+c(Cl-)
D.常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西河池高中高一下第二次月考化学试卷(解析版) 题型:实验题
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是_________;
(2)实验室中现有Na2SO4、MgSO4、HgSO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是__________;
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
4mol·L-1H2SO4溶液/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=______mL,V9=_____mL;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_____________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西河池高中高一下第二次月考化学试卷(解析版) 题型:选择题
反应N2+3H 2NH3,正反应的反应速率为v1,逆反应的反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为( )
2NH3,正反应的反应速率为v1,逆反应的反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大 B.同时减小 C.v1增大,v2减小 D.v1减小,v2增大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西河池高中高一下第二次月考化学试卷(解析版) 题型:选择题
张清莲是我国著名的化学家,1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值。这是原子量表中的首次采用我国测定的原子量值。己知In的原子核外电子由里到外排布为2, 8, 18, 18, 3。则下列关于In的说法不正确的是( )
A.In为过渡元素 B.In为长周期元素
C.In易导电导热 D.In 在反应中容易失电子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高一下期中化学试卷(解析版) 题型:选择题
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
现象或操作 | 解 释 | |
A | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
B | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成有色产物能溶于浓硝酸 |
C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
D | 铜片放入浓硫酸中,无明显变化 | 说明铜在冷的浓硫酸中发生钝化 |
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:填空题
铜及其化合物在工农业生产及日常生活中应用非常广泛.
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
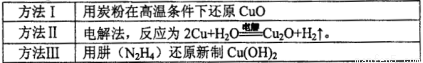
①工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法I,其原因是____________。
②已知:
2Cu(s)+1/2O2(g)═Cu2O(s)△H=-169kJ•mol-1,
C(s)+1/2O2(g)═CO(g)△H=-110.5kJ•mol-1,
Cu(s)+1/2O2(g)═2CuO(s)△H=-157kJ•mol-1
则方法I发生的反应:2CuO(s)+C(s)=Cu20(s)+CO(g); △H=____________kJ/mol。
(2)氢化亚铜是一种红色固体,可由下列反应制备:4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4.
该反应每转移3mol电子,生成CuH的物质的量为____________。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图所示。
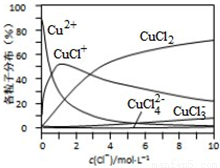
①当c(Cl-)=9mol•L-1时,溶液中主要的3种含铜物种浓度大小关系为____________。
②在c(Cl-)=1mol•L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为____________(任写一个).
(4)已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
①在铜盐溶液中Cu2+发生水解反应的平衡常数为____________,(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3•L-3)
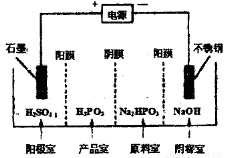
②电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过),则产品室中反应的离子方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com