
| A.H2O2溶液有氧化性,可用于杀菌消毒 |
| B.氯化镁是一种电解质,可用于电解法制镁 |
| C.液氨汽化时要吸收大量的热,可用作制冷剂 |
| D.Na2SO4能使蛋白质发生变性,可用于提纯蛋白质 |
科目:高中化学 来源:不详 题型:单选题
| A.苏打和小苏打都既能与酸反应又能与氢氧化钠反应 |
| B.等质量的苏打、小苏打分别与足量的同种盐酸反应,小苏打消耗的盐酸多 |
| C.向小苏打溶液中滴入氢氧化钡溶液无沉淀,而苏打溶液中滴入氢氧化钡溶液出现沉淀 |
| D.等质量的苏打、小苏打分别与足量稀硫酸反应,小苏打产生的二氧化碳多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中水电离出的H+个数:②>① |
| B.溶液中阴离子的物质的量浓度之和:②>① |
| C.①溶液中:c(CO32-)>c(H2CO3) |
| D.②溶液中:c(HCO3-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.225mol/L | B.0.25mol/L | C.0.45mol/L | D.0.9mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.能发生铝热反应 | B.铝的化学性质不活泼 |
| C.常温下铝不与氧气反应 | D.铝表面能形成致密的氧化膜 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 操作 | 解释或结论 |
| A | 向某溶液中加入NaOH溶液,出现白色沉淀 | 溶液中一定含有Mg2+ |
| B | 在饱和的SO2溶液中通入NO2气体,溶液的pH变小 | SO2具有还原性 |
| C | 某酸HX稀释100倍后,pH增加2 | HX是强酸 |
| D | 配制FeSO4溶液时,应加入过量铁粉和稀硫酸 | 溶液中不断产生FeSO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
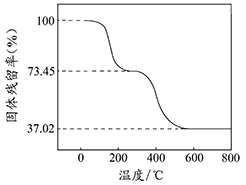
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c > b > d > a | B.b > a > d > c | C.a > b > c > d | D.d > c > b > a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com