
(1)金属锰可以用四氧化三锰为原料通过铝热法来制备。试写出配平的化学方程式。
(2)CS2是一种有恶臭的液体,把它滴入硫酸酸化的高锰酸钾水溶液,将析出硫磺,同时放出CO2,写出配平的化学式方程式。
科目:高中化学 来源: 题型:
| 1-x |
| x |
| 1-x |
| x |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2010年郑州市智林学校高二下学期期末考试化学试题 题型:填空题
(12分)过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
Ⅰ. 二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是 。
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
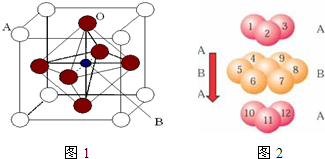
Ⅱ. 2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如右图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
(1)用A、B、O表示这类特殊晶体的化学式: 。
(2)已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3, (x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为: 。(用含x的代数式表示)
(3)Mn的外围电子轨道表示式为: 。
(4)下列有关说法正确的是 。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.铬的堆积方式与钾相同,则其堆积方式如右图:
D.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
查看答案和解析>>
科目:高中化学 来源:2012-2013年四川昭觉中学高二上学期期中考试化学试卷(带解析) 题型:填空题
过渡金属元素氧化物的应用研究是目前科学研究的前沿之一。2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如下图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
(1)用A、B、O(氧)表示此类特殊晶体的化学式 ;
(2)已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3, (x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为 ;(用含x的代数式表示)
(3)Mn的外围电子排布式为 ,在元素周期表中的位置是第 周期,第 族;
(4)下列有关说法正确的是 。
A.镧、锰、氧分别位于周期表f、d、p区
B.CaO的熔点为2614℃,属于原子晶体
C.铬的堆积方式与钾相同,则其堆积方式如下图:
D.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com