
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Cl2能与碱反应 | Cl2可用于制漂白粉 |
| B | Si有导电性 | SiO2可用于制光导纤维 |
| C | N2性质稳定 | N2可作为食品保护气 |
| D | 锌的金属性比铁强 | 轮船外壳上焊接若干锌块以减缓其腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
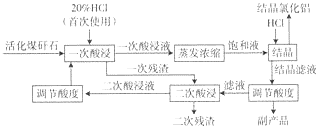
| HCl气体体积/(m3.L-1) | 结晶效率/% | HCl利用效率/% |
| 0.0375 | 11.8 | 93.2 |
| 0.075 | 31.5 | 89.8 |
| 0.1225 | 59.0 | 83.2 |
| 0.15 | 68.0 | 74.9 |
| 0.1875 | 71.0 | 67.8 |
| 0.225 | 73.1 | 59.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的原子晶体和分子晶体互为同素异形体 | |
| B. | 在一定条件下,CO2原子晶体转化为分子晶体是物理变化 | |
| C. | CO2的原子晶体和CO2分子晶体具有相同的物理性质 | |
| D. | 在CO2的原子晶体中,每个碳原子周围结合四个氧原子,每个氧原子周围结合两个碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
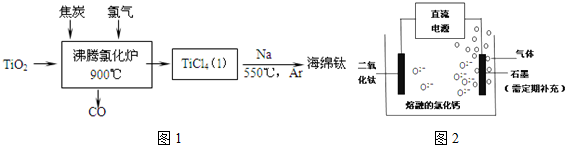
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com