
| A. | 称取10.6gNaCO3,加入100mL容量瓶中,加水溶解,定容 | |
| B. | 称取10.6gNaCO3,加入100mL蒸馏水,搅拌,溶解 | |
| C. | 移液时未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 定容后,反复倒转,摇匀 |
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 ,将过量A通入由②和⑤形成的阴离子的盐溶液的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,将过量A通入由②和⑤形成的阴离子的盐溶液的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 49个 | B. | 50个 | C. | 51个 | D. | 102个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温结构陶瓷是新型无机非金属材料 | |
| B. | 钢是用量最大、用途最广的合金,分为碳素钢和合金钢 | |
| C. | 硅芯片是各种计算机、微电子产品的核心材料 | |
| D. | 单晶硅常用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生用0.1000mol•L-1标准氢氧化钡溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准氢氧化钡溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
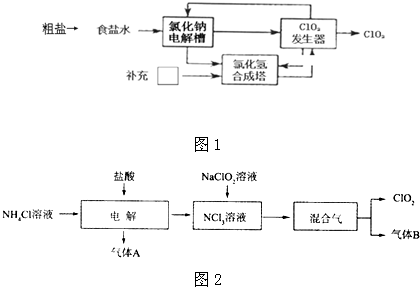
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com