
(5分)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2 2NH3
2NH3
(1)在N2+3H2 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为
;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为
;
A.2 s B.3 s C.4 s D.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是 ;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min-1 D.v(N2)=0.002mol·L-1·min-1
(3)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是
。
2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是
。
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1mol N≡N键的同时,断裂6 mol N—H键
D.反应消耗N2、H2与产生NH3的速率之比1︰3︰2
(1) B (2分)(2) B (1分)(3)BC (2分)
【解析】(1)υ(NH3)=2υ(N2)=0.3
mol·L-1·s-1=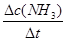 =
=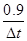 ,故△t=3 s
,故△t=3 s
(2)将四选项以方程式系数转换为以同一物质来表示反应速率即可求得答案为B
(3)注意本题环境为绝热、恒容:
A:由于气体的质量和容积不变,故密度也是定值,不能做为平衡状态的判断标志。
B:只要没有到达平衡状态,反应就会有热量的放出或吸收,在绝热的环境中,容器内的温度就会变化,当温度不变时,说明也就是到了平衡状态;
C:断裂1mol N≡N键的同时,断裂6 mol N—H键恰好说明了正逆反应速度相等
D:任何状态下三者的速率比均为1︰3︰2,不能做为判断标志。


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省宁波市八校高一下学期期末联考化学试卷(带解析) 题型:填空题
(5分)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2 2NH3
2NH3
(1)在N2+3H2 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
A.2 s B.3 s C.4 s D.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是 ;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min-1 D.v(N2)=0.002mol·L-1·min-1
(3)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1mol N≡N键的同时,断裂6 mol N—H键
D.反应消耗N2、H2与产生NH3的速率之比1︰3︰2
查看答案和解析>>
科目:高中化学 来源:2011-2012学年内蒙古巴市一中高一下学期期末考试化学试卷(带解析) 题型:填空题
(6分)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2 2NH3
2NH3
(1)在N2+3H2 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
A.2 s B.3 s C.4 s D.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是 ;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min- D.v(N2)=0.002mol·L-1·min-1
(3)在一个绝热、容积不变的密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1mol N≡N键的同时,断裂6 mol N—H键
D.反应消耗N2、H2与产生NH3的速率之比1︰3︰2
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济南市高三下学期5月针对训练理综化学试卷(解析版) 题型:填空题
随着世界粮食需求量的增加,农业对化学肥料的需求越越大。氮肥是需求最大的一种化肥。氮肥的生产和合理施用在农业生产中起着重大作用。合成氨及化肥生产流程示意图如下:

(1)目前,工业上用铁触媒作催化剂,在20~50 MPa、450℃左右用氮、氢混合气体在
中进行合成氨。则沿X方向回去的物质是 。
(2)在侯氏制碱法中,从沉淀池中得到的母液要通人氨气、降温并加入 (填化学式),目的是 。
(3)沉淀池中的化学方程式是 。
(4)工业上将氨催化氧化可制硝酸。在硝酸生产中,催化剂铂网在氨的催化氧化反应中起的作 用是 。硝酸工业尾气对环境污染严重,若在催化剂存在下用甲烷将其中的一氧化氮还原为对空气无污染的物质,其反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com