
| A. | ①⑤⑥ | B. | ④⑥ | C. | ②④⑦ | D. | ③④⑧ |
分析 化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成,据此分析判断.
解答 解:①皂化反应是油脂发生了化学反应生成了新的物质,属于化学变化;
②给装有氯化铵的试管加热,在管口又有白色晶体产生是氯化铵分解生成的氨气和氯化氢,氨气和氯化氢反应生成氯化铵,属于化学变化;
③太阳光照在装有氯水的瓶子上,瓶子里有气泡产生是氯水中氯气和水反应生成的次氯酸见光分解生成的氧气,属于化学变化;
④碘受热有紫色蒸气产生是碘单质升华属于物理变化;
⑤碳酸钠晶体的风化是分解失去结晶水,属于化学变化;
⑥向皂化后的溶液中加入氯化钠粉末使肥皂析出属于盐析,过程中无新物质生成,属于物理变化;
⑦铁、铝常温遇浓硫酸发生钝化,是浓硫酸的强氧化性,属于化学变化;
⑧二氧化氮气体遇冷颜色变浅.是化学平衡移动,生成了更多的四氧化二氮,属于化学变化;
只有④⑥符合,
故选B.
点评 本题难度不大,解答时要分析变化过程中是否有新物质生成,若没有新物质生成属于物理变化,若有新物质生成属于化学变化.


科目:高中化学 来源: 题型:选择题
| A. | Fe2+0.45Fe3+0.50O | B. | Fe2+0.85Fe 3+0.10O | ||
| C. | Fe2+0.15Fe3+0.80O | D. | Fe2+0.20Fe 3+0.75O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
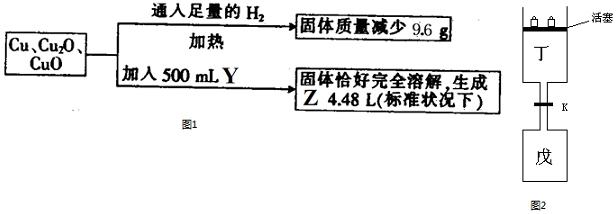
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
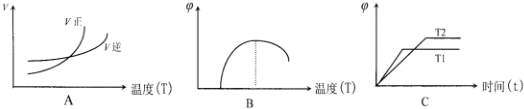
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
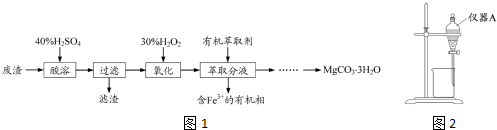
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
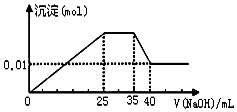 某无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+,NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
某无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+,NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:| A. | 依据电荷守恒,原溶液中NO3-的物质的量应为0.03mol | |
| B. | 原溶液一定不存在H+、Cu2+、CO32- | |
| C. | 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n(NH4+)=1:1:2 | |
| D. | 实验所加的NaOH的浓度为2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
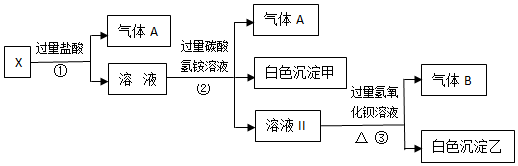
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
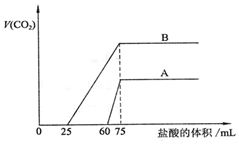 取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸体积之间的关系如图所示,试回答下列问题:
取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸体积之间的关系如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | 元素的最高化合价Z大于Y | |
| B. | 元素的气态氢化物的稳定性W强于Y | |
| C. | 原子半径Z比Y小 | |
| D. | 元素的最高价氧化物的水化物酸性X大于W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com