


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
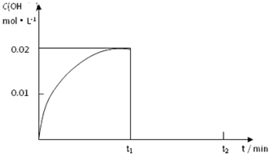 I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g)| 加热 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,烧杯甲中放100mL6mol/L的盐酸溶液,烧杯乙中放入100mL冷水.现向烧杯甲的溶液中放入25gNaOH溶液固体,同时向乙烧杯中放入NH4NO3固体,搅拌使之溶解.
如图所示,烧杯甲中放100mL6mol/L的盐酸溶液,烧杯乙中放入100mL冷水.现向烧杯甲的溶液中放入25gNaOH溶液固体,同时向乙烧杯中放入NH4NO3固体,搅拌使之溶解.查看答案和解析>>
科目:高中化学 来源: 题型:
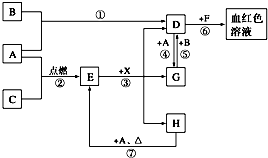 A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体.它们之间的转化关系如下图所示(其中某些反应条件和部分反应物已略去).
A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体.它们之间的转化关系如下图所示(其中某些反应条件和部分反应物已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
 I、已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.0kJ?mol-1
I、已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.0kJ?mol-1查看答案和解析>>
科目:高中化学 来源: 题型:
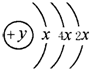 A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B元素最外层电子数是次外层电子数的四分之一,C元素的气态氢化物的水溶液显碱性,据此填空:
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B元素最外层电子数是次外层电子数的四分之一,C元素的气态氢化物的水溶液显碱性,据此填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| 代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 半径(pm) | 30 | 64 | 66 | 91 | 70 | 106 | 110 | 186 | 125 | 232 |
| 主要化合价 | -1,+1 | -1 | -2 | -4,+4 | -3,+5 | -2,+4,+6 | -4,+4 | +1 | +3 | +1 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com