
| A. | 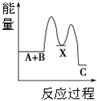 反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0),图表示总反应过程中能量变化 | |
| B. | 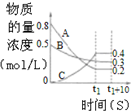 图表示反应的化学方程式为3A+B═2C | |
| C. | 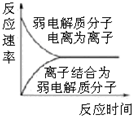 图表示弱电解质在水中建立电离平衡的过程 | |
| D. | 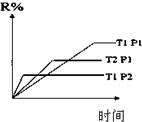 图表示反应M(g)+N(g)?R(g)+2L(?)是放热反应且L是气体 |
分析 A.反应物总能量高于生成物总能量为放热反应,反应物总能量低于生成物总能量为吸热反应;
B.依据图象给出物质的物质的量浓度变化判断反应物和生成物,依据转化量之比等于计量系数之比判断系数;
C.弱电解质电离为可逆过程:弱电解质电离速率与离子结合为分子速率相等时达到电离平衡;
D.依据先拐先平高温高压结合温度、压强对化学平衡移动的影响解答;
解答 解:A.从图象可知:A+B→X,反应物总能量低于生成物总能量为吸热反应,所以(△H>0),X→C,反应物总能量高于生成物总能量为放热反应,△H<0,图表示总反应过程中能量变化,故A正确;
B.分析图可知反应物生成物t1共存说明反应为可逆反应,从图象可知达到平衡时,A、B物质的量浓度分别减小0.6,0.2,为反应物,C物质的量浓度增加0.4为生成物,依据转化量之比等于计量系数之比得反应方程式:3A+B?2C,故B错误;
C.弱电解质电离为可逆过程:弱电解质电离速率与离子结合为分子速率相等时达到电离平衡,图象符合弱电解质在水中建立电离平衡的过程,故C正确;
D.由图象可知:T2大于T1,当其他条件不变,升高温度R的百分含量降低,则平衡逆向移动,该反应为放热反应,压强:P2大于P1,当其他条件不变,增大压强,R的百分含量降低,平衡逆向移动,则逆向为气体系数减小的反应,则L为气体,故D正确;
故选:B.
点评 本题为图象题,考查了反应过程中能量变化图象,化学平衡有关图象,掌握外界条件对化学平衡的影响是解题关键,注意先拐先平,高温高压的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 饱和溶液的密度$\frac{(a+b)}{V}$ | |
| B. | 饱和溶液的物质的量浓度$\frac{100a(M-18x)}{MV}$ | |
| C. | 25℃,R的溶解度$\frac{100a(M-18x)}{(bM+18ax)}$ | |
| D. | 饱和溶液的质量分数$\frac{a(M-18x)}{(a+b)M}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
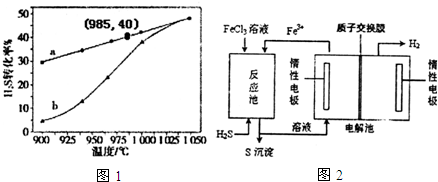
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
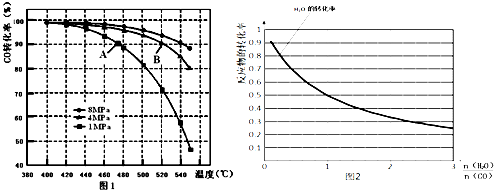
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2013年12月17日,中国国土资源部召开新闻发布会,宣布在广东沿海珠江口盆地东部海域首次钻获高纯度可燃冰.可燃冰的主要成分是甲烷,甲烷既是清洁的燃料,也是重要的化工原料.
2013年12月17日,中国国土资源部召开新闻发布会,宣布在广东沿海珠江口盆地东部海域首次钻获高纯度可燃冰.可燃冰的主要成分是甲烷,甲烷既是清洁的燃料,也是重要的化工原料.| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.20 | 0.10 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s),△H=-216kJ•mol-1,反应物总能量小于生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1mol氢分子的能量为E2,则2E1>E2 | |
| C. | 101kPa时,2H2(g)+O2(g)=2H2O(1),△H=-571.6kJ•mol-1,若生成气态水,△H小于-571.6kJ•mol-1 | |
| D. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3溶液 | B. | NaCl溶液 | C. | AgNO3溶液 | D. | CuCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com