
【题目】50mL 0.5mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
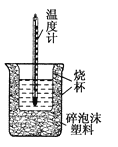
(1)从实验装置上看,图中尚缺少一种玻璃仪器是__________。
(2)大烧杯上如不盖硬纸板,测得的中和热________(填“偏大”或“偏小”或“无影响”)。
(3)实验中改用60mL 0.50mol·L-1盐酸跟50mL 0.50mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“偏大”或“相等”或“偏小”),所求中和热________(填“相等”或“不相等”),简述理由:_________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________;用50mL 0.5mol·L-1盐酸与50mL 0.50mol·L-1 NaOH溶液进行中和测定,测得的中和热数值会________。(填“偏大”、“偏小”或“无影响”)
(5)取50 mL 0.50 mol/L NaOH溶液和30 mL0.50 mol/L硫酸溶液进行实验,实验数据如下表。
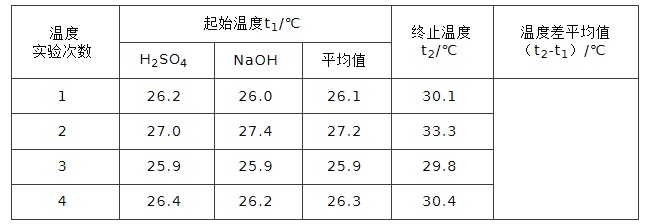
则中和热ΔH= (取小数点后一位)。(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃))
【答案】27.环形玻璃搅拌棒(2)偏小
(3)相等;相等,简述理由:中和热是指生成1mol水所放出的热量,而与实际参加反应的酸、碱的物质的量无关(4)偏小;偏小(5)ΔH=53.8 KJ/mol
【解析】
试题分析::(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
(2)大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小;
(3)改用60mL 0.50molL-1盐酸与50mL 0.50molL-1 NaOH溶液进行反应,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;故答案为:相等;因为中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的能量,与酸碱的用量无关;
(4)一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替稀NaOH溶液反应,反应放出的热量偏小; NaOH的物质的量等于HCl的物质的量,使盐酸完全被中和的时间会变长,热量散失多,测得的结果偏小;
(5)据表中数据可知,1、2、3、4次温差分别为4.0、6.1、3.9、4.1,第二次温差太大,忽略,所以其平均温差为(4.0+3.9+4.1)/3℃=4.0℃,Q=cm△t=4.2J/(g℃)×80g×4.0℃=1344J=1.344KJ,0.025molNaOH反应放热1.344KJ,1molNaOH反应生成1mol水时放热:1.344KJ/0.025mol=53.8KJ/mol,所以该反应表示中和热的热化学方程式:NaOH(aq)+1/2H2SO4(aq)=H2O(l)+1/2Na2SO4(aq)△H=-53.8KJ/mol.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室中保存下列化学药品的方法不妥当的是( )
A. 将AgNO3晶体放在棕色试剂瓶中
B. NaOH溶液保存在带橡胶塞的细口试剂瓶中
C. 金属钾、钠和非金属白磷保存在煤油中
D. 浓硝酸溶液保存在棕色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示,下列说法中正确的是
2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示,下列说法中正确的是
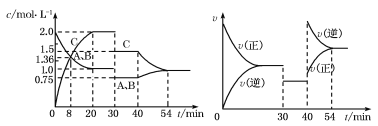
A.30 min~40 min间该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30 min时降低温度,40 min时升高温度
D.8 min前A的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
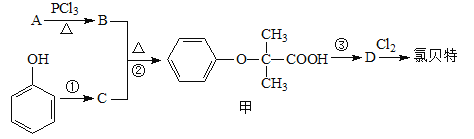
【题目】氯贝特(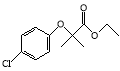 )是临床上一种降脂抗血栓药物,它的一条合成路线如下:
)是临床上一种降脂抗血栓药物,它的一条合成路线如下:
提示:Ⅰ.图中部分反应条件及部分反应物、生成物已略去。
Ⅱ.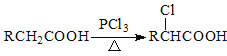
Ⅲ.![]()
⑴氯贝特的分子式为 。
⑵若8.8 g A与足量NaHCO3溶液反应生成2.24 L CO2(标准状况),且B的核磁共振氢谱有两个峰,则A的结构简式为 。(相对原子质量:H-1、C-12、O-16)
⑶要实现反应①所示的转化,加入下列物质不能达到目的的是 (填选项字母)。
a.Na b.NaOH c.NaHCO3 d.CH3COONa
⑷反应②的反应类型为 ,其产物甲有多种同分异构体,同时满足以下条件的所有甲的同分异构体有 种(不考虑立体异构)。
① 1,3,5-三取代苯;
② 属于酯类且既能与FeCl3溶液显紫色,又能发生银镜反应;
③ 1 mol该同分异构体最多能与3 mol NaOH反应。
⑸写出B与足量NaOH溶液反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2常用于漂白各种竹林制品.如下实验现象能体现SO2漂白性的是( )
A.SO2使酸性高锰酸钾溶液褪色
B.SO2使滴有酚酞的氢氧化钠溶液褪色
C.SO2使品红溶液褪色
D.SO2使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组进行物质漂白性的实验探究
Ⅰ.应用下图所示的方法实验,其中气体A的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:
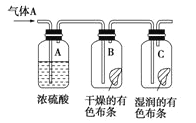
(1)该项研究(实验)的主要目的是___________________。
(2)浓硫酸的作用是____________,与研究目的直接相关的实验现象是__________________________。
(3)将石蕊试液滴到新制氯水中的现象_______________________。
Ⅱ.为探究SO2的漂白是SO2直接作用于有色物质,还是SO2与水反应的产物H2SO3的作用,设计如图装置进行实验:(图中所用硫酸的质量分数为70%)
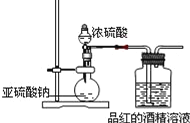

(1)为探究干燥的SO2 能不能使品红褪色,请指出设计的实验装置图中两个明显的不足中的一个______________
(2)按照修改后的装置,实验中控制SO2以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.这说明品红褪色的原因不是SO2直接导致.所以,SO2 通过品红水溶液后,引起品红褪色的可能是________.(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]有机物F是一种香料,其合成路线如图所示:
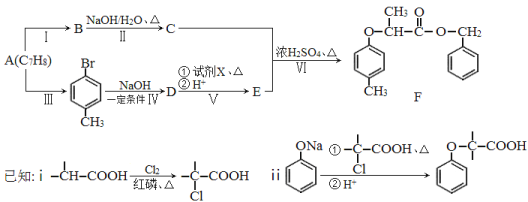
(1)A的名称为 ,试剂X的结构简式为 ,步骤Ⅵ的反应类型为 。
(2)步骤Ⅰ的反应试剂和条件分别为 、 。
(3)步骤Ⅱ反应的化学方程式为 。
(4)满足括号中条件(①苯环上只有两个取代基,②能与FeCl3溶液发生显色反应,③能发生水解反应和银镜反应)的E的同分异构体有 种,其中核磁共振氢谱峰面积比为6︰2︰2︰1︰1的分子的结构简式为 。
(5)依据题中信息,完成以![]() 为原料制取
为原料制取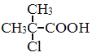 的合成路线图。
的合成路线图。
合成路线图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)![]() nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积(容器容积)的关系如下表所示:
nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积(容器容积)的关系如下表所示:
气体体积/L c (Y)/mol·L-1 温度/℃ | 1 | 2 | 3 |
100 | 1.00 | 0.75 | 0.53 |
200 | 1.20 | 0.90 | 0.63 |
300 | 1.30 | 1.00 | 0.70 |
下列说法正确的是
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是( )
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C. 蒸发结晶时应将溶液蒸干
D. 称量时,称量物放在称量纸上置于托盘天平的左盘,砝码放在托盘天平的右盘中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com