
【题目】(2014山东)根据原子结构及元素周期律的知识,下列推断正确的是
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl、S2、Ca2+、K+半径逐渐减小
D.![]() Cl与
Cl与![]() Cl得电子能力相同
Cl得电子能力相同
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】桶烯(Barrelene)结构简式如图所示,则下列有关说法一定正确的是

A. 0. 1mol桶烯完全燃烧需要消耗氧气22. 4L
B. 桶烯在一定条件下能发生加成反应,不能发生加聚反应
C. 桶烯二氯取代产物只有三种
D. 桶烯与苯乙烯(C6H5CH=CH2)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这结论的理论是
A. 构造原理 B. 泡利不相容原理
C. 洪特规则 D. 能量最低原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】任何科学真理的发现,都不是一帆风顺的,门捷列夫的元素周期表奠定了现代化学和物理学的理论基础.下列关于元素周期表的说法中,不正确的是( )
A.周期表中的副族、Ⅷ族都是金属元素
B.周期表中的ⅡA族都是金属元素
C.周期表中的非金属元素都位于短周期
D.周期表中的0族元素都是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,原子半径的大小为:r(Y)> r(X)> r(Z),三种元素的原子序数之和为16。X、Y、Z三种元素的常见单质在在适当条件下可发生右图变化,其中B和C均为10电子分子。下列说法不正确的是
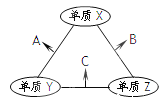
A. X元素位于ⅥA 族 B. A难溶解于B中
C. A和C不可能发生氧化还原反应 D. B的沸点高于C的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双隔膜电解池的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气.对该装置及其原理判断正确的是( )
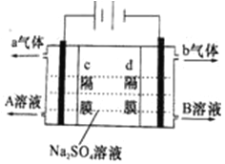
A.a气体为氢气,b气体为氧气
B.A溶液为氢氧化钠,B溶液为硫酸
C.c隔膜为阳离子交换膜、d隔膜为阴离子交换膜
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O![]() 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其中pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是
A.HX、HZ、HY B.HY、HZ、HX C.HX、HY、HZ D.HZ、HY、HX
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com