
【题目】氨是一种重要的化工原料。
Ⅰ、某学习小组同学设计了下图所示的实验装置(部分夹持仪器未画出),进行氨气实验室制备且探究氨气的还原性及产物的检验。
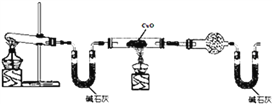
实验现象为:黑色CuO变为红色;干燥管中无水CuSO4粉末变为蓝色;同时生成一种无色无味无污染的气体。
(1)请写出大试管中反应的化学方程式_______________________________________。
(2)请写出氨气与CuO反应的化学方程式_________________________________________。
(3)该装置存在明显缺陷,请指出存在的问题______________________。
Ⅱ、哈伯因为将氮气和氢气在一定条件下合成氨气的成果面获得1918年诺贝尔化学奖。现将1molN2和3molH2充入一恒容的密闭容器中,使其在一定条件下达到平衡N2+3H2![]() 2NH3,下列哪些状态一定是达到平衡的状态?(_____)
2NH3,下列哪些状态一定是达到平衡的状态?(_____)
A.混合气体的平均相对分子质量不随时间改变而改变的状态
B.N2、H2、NH3的总物质的量不随时间改变而改变的状态
C.混合气体的密度不随时间改变而改变的状态
D.单位时间内0.1molNH3分解的同时,有0.05molN2生成的状态
Ⅲ、下图是一种电化学制备NH3的装置,图中陶瓷在高温时可以传输H+。
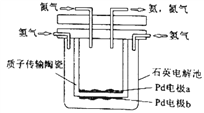
(1)H+经质子传输陶瓷由_____________流向_______________。(选填“a”或“b”)
(2)阴极发生的电极反应为_________________________________。
【答案】 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 3CuO+2NH3
CaCl2+2NH3↑+2H2O 3CuO+2NH3![]() 3Cu+N2+3H2O 此装置没有尾气吸收装置 AB a b N2+6H++6e-=2NH3
3Cu+N2+3H2O 此装置没有尾气吸收装置 AB a b N2+6H++6e-=2NH3
【解析】Ⅰ、 (1). 实验室用氯化铵和氢氧化钙反应生成氨气,方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O ; (2). 氨气和氧化铜反应,黑色CuO变为红色说明生成铜,干燥管中无水CuSO4粉末变为蓝色,说明生成水,一种无色无味无污染的气体为氮气,所以反应方程式为:3CuO+2NH3
CaCl2+2NH3↑+2H2O ; (2). 氨气和氧化铜反应,黑色CuO变为红色说明生成铜,干燥管中无水CuSO4粉末变为蓝色,说明生成水,一种无色无味无污染的气体为氮气,所以反应方程式为:3CuO+2NH3![]() 3Cu+N2+3H2O,故答案为:3CuO+2NH3
3Cu+N2+3H2O,故答案为:3CuO+2NH3![]() 3Cu+N2+3H2O ; (3). 反应过程中氨气可能有剩余,此装置没有对氨气进行处理而造成污染,故答案为:此装置没有尾气吸收装置; Ⅱ、对于氮气和氢气合成氨气的反应来说,A.混合气体的平均相对分子质量不随时间改变而改变的状态可以说明反应到平衡,故正确;B.因为反应前后气体的物质的量改变,所以N2、H2、NH3的总物质的量不随时间改变而改变的状态可以说明反应到平衡,故正确;C.因为反应体系中的体积不变,气体总质量守恒,所以混合气体的密度不随时间改变而改变的状态不能说明反应到平衡,故错误;D.单位时间内0.1molNH3分解的同时,有0.05molN2生成的状态,都表示逆向反应,不能说明反应到平衡,故错误。故选AB。Ⅲ、(1)氮气和氢气反应生成氨气的反应中氮气化合价降低,在阴极反应,氢气化合价升高,在阳极反应,所以b为阳极,a为阴极,氢离子从阳极流向阴极,故答案为: b流向a ;(2)氮气在阴极得到电子结合氢离子生成氨气,电极反应为N2+6H++6e-=2NH3,故答案为:N2+6H++6e-=2NH3。
3Cu+N2+3H2O ; (3). 反应过程中氨气可能有剩余,此装置没有对氨气进行处理而造成污染,故答案为:此装置没有尾气吸收装置; Ⅱ、对于氮气和氢气合成氨气的反应来说,A.混合气体的平均相对分子质量不随时间改变而改变的状态可以说明反应到平衡,故正确;B.因为反应前后气体的物质的量改变,所以N2、H2、NH3的总物质的量不随时间改变而改变的状态可以说明反应到平衡,故正确;C.因为反应体系中的体积不变,气体总质量守恒,所以混合气体的密度不随时间改变而改变的状态不能说明反应到平衡,故错误;D.单位时间内0.1molNH3分解的同时,有0.05molN2生成的状态,都表示逆向反应,不能说明反应到平衡,故错误。故选AB。Ⅲ、(1)氮气和氢气反应生成氨气的反应中氮气化合价降低,在阴极反应,氢气化合价升高,在阳极反应,所以b为阳极,a为阴极,氢离子从阳极流向阴极,故答案为: b流向a ;(2)氮气在阴极得到电子结合氢离子生成氨气,电极反应为N2+6H++6e-=2NH3,故答案为:N2+6H++6e-=2NH3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是( )
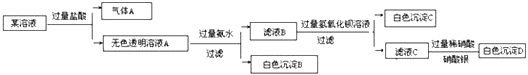
A. 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl-四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一氧化碳与水蒸气的反应为:CO(g)+H2O (g)![]() CO2 (g)+H2 (g),在427℃时的平衡常数是9.4。回答下列问题:
CO2 (g)+H2 (g),在427℃时的平衡常数是9.4。回答下列问题:
(1)氢气作为燃料与汽油相比,其优点是____________________________________________(答一条即可)。
(2)800℃时,在容积为2.0L的密闭容器中充入2.0mlCO(g)和3.0molH2O(g),保持温度不变,4min后
反应达到平衡,测得CO的转化率为60%。
①4min内H2的平均化学反应速率为__________mol/(L·min)。
②800℃时该反应的平衡常数值为__________。请结合题中的信息判断该反应的△H__________0。
(3)一定条件下,设起始加入二氧化碳和氢气且![]() = Z,在恒压下.平衡时CO2的体积分数φ(CO2) 与Z和T(温度)的关系如图所示,下列说法正确的是(_____)
= Z,在恒压下.平衡时CO2的体积分数φ(CO2) 与Z和T(温度)的关系如图所示,下列说法正确的是(_____)

A.该反应的焓变△H>0
B.图中Z的大小为b>3>a
C.图中x 点对应的平衡混合物中![]() = 3
= 3
D.温度不变时,图中x点对应的平衡在加压后φ(CO2)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列碳原子的物质的量为1 mol的是( )
A. 0.012 kg C B. 0.012 kg12C
C. 0.012 kg13C D. 0.012 kg12C和13C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于共价键成键因素的是( )
A.共用电子对在两原子核之间出现的概率高
B.共用的电子必须配对
C.两原子体积大小要适中
D.成键后体系能量降低,趋于更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.3 g纯净的金属钠在干燥的空气中,被氧化后得到3.5 g固体,由此可判断出产物是( )
A. 氧化钠 B. 过氧化钠
C. 氧化钠和过氧化钠的混合物 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验某一溶液中是否含有氯离子,可选用的试剂是
A. 硝酸银溶液 B. 稀盐酸酸化的硝酸银溶液
C. 稀硝酸酸化的硝酸银溶液 D. 稀硫酸酸化的硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究。

已知:PdCl2溶液可用于检验CO,反应的化学方程式为CO + PdCl2 + H2O = CO2 + 2HCl + Pd(产生黑色金属钯粉末,使溶液变浑浊)。
(1)实验时要通入足够长时间的N2,其原因是________________________。
(2)装置B的作用是____________________________。
(3)装置C、D中所盛试剂分别为___、___,若装置C、D中溶液均变浑浊,且经检测两气体产物的物质的量相等,则该反应的化学方程式为____________________________。
(4)该装置的缺点是____________________________。
(5)设计实验证明碳酸的酸性比硅酸的强:____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com