
| A. | 碱性锌锰电池是二次电池 | |
| B. | 铅蓄电池是二次电池 | |
| C. | 二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生 | |
| D. | 燃料电池的活性物质没有储存在电池内部 |
分析 A.一次电池是放电后不能进行使用,二次电池是放电后可以充电后继续使用;
B.铅蓄电池是二次电池,可以充电;
C.蓄电池是二次电池放电后可以充电重新使用;
D.燃料在两个电极上发生氧化还原反应把化学能转化为电能.
解答 解:A.一次电池是放电后不能进行使用,二次电池是放电后可以充电后继续使用,碱性锌锰电池是一次电池,故A错误;
B.铅蓄电池是二次电池,可以放电充电,故B正确;
C.蓄电池是二次电池放电后可以充电重新使用,使活性物质获得再生,故C正确;
D.燃料在两个电极上发生氧化还原反应把化学能转化为电能,不是在电池内部燃烧,故D正确;
故选A.
点评 本题考查了原电池的原理分析,为高频考点,注意电池分类,一次电池、二次电池的工作实质,把握原电池的分类以及工作原理,题目难度不大.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有离子键 | B. | 属于原子晶体 | ||
| C. | 既有离子键又有共价键 | D. | 属于离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
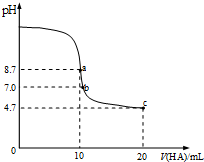 室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点溶液中:c(Na+)>c(A-)>c(H+)>c(HA) | B. | a、c两点溶液中水的电离程度相同 | ||
| C. | b点溶液中:c(Na+)=c(A-)+c(HA) | D. | c点溶液中:c(A-)>c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 官能团 | 选择试剂 | 实验现象 | 有关反应的化学方程式或离子方程式 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com