
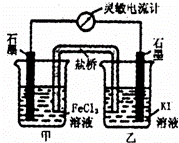
控制适合的条件,将反应2Fe3++2I﹣⇌2Fe2++I2设计成如图所示的原电池.下列判断不正确的是( )
|
| A. | 反应开始时,乙中石墨电极上发生氧化反应 |
|
| B. | 电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极 |
|
| C. | 电流计读数为零时,反应达到化学平衡状态 |
|
| D. | 反应开始时,甲中石墨电极上Fe3+被还原 |
| 原电池和电解池的工作原理. | |
| 专题: | 电化学专题. |
| 分析: | A.将反应2Fe3++2I﹣⇌2Fe2++I2设计成原电池,铁离子得电子发生还原反应,则甲中石墨电极为正极,乙中石墨电极为负极; B.电流计读数为零后,在甲中溶入FeCl2固体,可逆反应向逆反应方向移动,乙中石墨得电子发生还原反应; C.电流计读数为零时,正逆反应速率相等,反应达到化学平衡状态; D.反应开始时,甲中石墨电极上得电子发生还原反应. |
| 解答: | 解:A.反应开始时,乙中石墨电极上碘离子失电子发生氧化反应,故A正确; B.电流计读数为零后,在甲中溶入FeCl2固体,可逆反应向逆反应方向移动,导致乙中碘得电子发生还原反应,则乙中石墨作正极,故B错误; C.电流计读数为零时,正逆反应速率相等,反应达到化学平衡状态,导致没有电流产生,故C正确; D.反应开始时,甲中石墨电极上铁离子得电子发生还原反应生成亚铁离子,故D正确; 故选B. |
| 点评: | 本题以化学平衡移动为载体考查了原电池原理,明确正负极的判断及正负极上电极反应式是解本题关键,注意等向甲中加入氯化亚铁溶液时,要考虑平衡移动方向,为易错点. |


科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,不正确的是( )
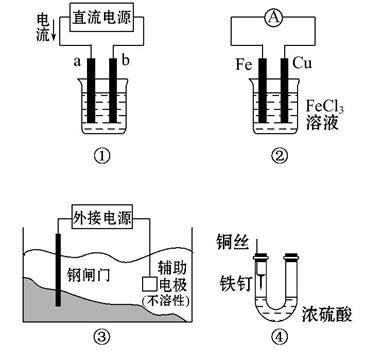
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应式是:Cu+2Fe3+====Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质属于同系物的是( )
|
| A. | CH3CH2CH2OH与CH3CH2CH2CH2OH |
|
| B. | ﹣OH与CH3CH2CHO |
|
| C. | CH3COOH与HCOOCH3 |
|
| D. | CH2ClCH2CH2Cl与CH3CH2CH2CH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
|
| A. | 未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 |
|
| B. | 因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
|
| C. | 铁制品应该连接在直流电源的负极 |
|
| D. | 镀锌层破损后即对铁制品失去保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应A+B=C+D 在低温下能自发进行,在高温下不能自发进行,对该反应过程△H、△S的判断正确的是( )
|
| A. | △H<0△S>0 | B. | △H>0△S>0 | C. | △H<0△S<0 | D. | △H>0△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
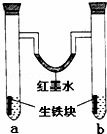
下图装置中,U型管内为红墨水,a,b试管内分别盛有食盐水和稀醋酸溶液,各加入生铁块,放置一段时间后,下列有关描述正确的是( )
|
| A. | 红墨水柱两边的液面变化是左高右低 |
|
| B. | b试管中溶液pH值减小 |
|
| C. | 两试管中相同的电极反应式是:Fe﹣3e﹣=Fe3+ |
|
| D. | a试管中阳极反应式为:O2+2H2O﹣4e﹣=4OH﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是几种常见的化学电源示意图,有关说法不正确的是 ( )
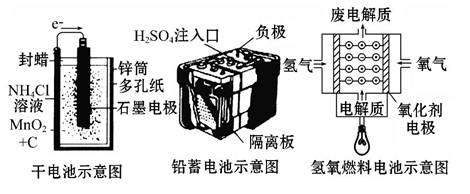
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207 g
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组用铝片与稀硫酸反应制取氢气,以下能够加快该反应速率的是( )
①用浓硫酸代替稀硫酸
②加热
③改用铝粉
④增大稀硫酸的体积
⑤加水
⑥加入少量硫酸铜
A.全部 B.②③⑥ C.①②③⑥ D.②③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com