
| 催化剂 |
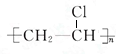 ,
,| 催化剂 |
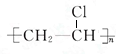 .
.


科目:高中化学 来源: 题型:
 A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2.请回答:
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
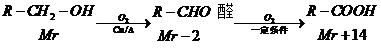
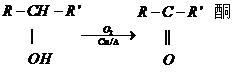 (酮中R、R′代表烃基且酮不能再被氧化为羧酸,其它物质中R、R′代表烃基或氢原子)
(酮中R、R′代表烃基且酮不能再被氧化为羧酸,其它物质中R、R′代表烃基或氢原子)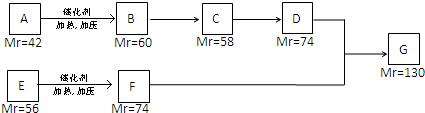
查看答案和解析>>
科目:高中化学 来源: 题型:
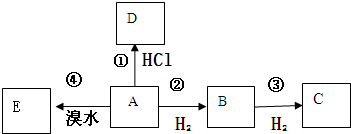
| ① |
| ② |
| ③ |
| ④ |
| ⑤ |
| H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
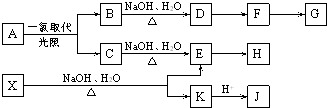
查看答案和解析>>
科目:高中化学 来源: 题型:
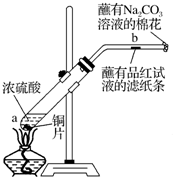
| A、将空气通过灼热的铜网可以除去O2 |
| B、用点燃的方法可以除去CO2中的CO |
| C、pH试纸使用前,先用蒸馏水湿润,再测定未知溶液的pH |
| D、稀释浓硫酸时,向浓硫酸中缓缓加入蒸馏水,用玻璃棒搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
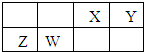
| A、Y元素最高价氧化物对应的水化物化学式为H3YO4 |
| B、原子半径由小到大的顺序为:X<Z<Y<W |
| C、与同浓度的盐酸反应,Z比W更剧烈 |
| D、W的金属性比Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向甲容器中充入一定量的氦气 |
| B、向乙容器中充入一定量的N2 |
| C、升高乙容器的温度 |
| D、增大甲容器的压强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com