

分析 (1)根据化学反应速率越快,到达平衡的时间越短;利用等效平衡来判断平衡移动来解答;
(2)根据容器中的压强对化学平衡的影响;
(3)根据浓度对化学平衡的影响,求出平衡移动后SO3的百分含量.
解答 解:(1)因A容器保持恒压,反应过程中体积变小,浓度增大,根据浓度越大,化学反应速率越快,到达平衡的时间越短,所以达到平衡所需时间A比B少,若A容器保持恒容,两容器建立的平衡等效,而实际上A容器体积减少,压强增大,平衡向正反应方向移动,所以A中SO2的转化率比B大,故答案为:少;大;
(2)平衡后,若向两容器通入数量不多的等量He,A容器体积增大,压强不变,参加反应的气体产生的压强减少,平衡向左移动,而B容器体积不变,浓度不变,平衡不移动,故答案为:向左;不;
(3)向两容器中通入2mol SO2与1mol的O2缓和气体,达到平衡后,A恒压中建立的平衡与原平衡等效,所以SO3的百分含量不变,B容器中建立的平衡相当于在原平衡的基础上增大压强,平衡正向移动,B容器中SO3的百分含量增大,故答案为:不变;增大.
点评 本题考查化学平衡移动的判断,题目难度较大,注意等效平衡的理解和应用,明确浓度不变反应速率不变,则平衡不移动.


科目:高中化学 来源: 题型:选择题
| A. | 化合物:CaCl2、NaOH、HCl、HD | B. | 同系物:苯、甲苯、乙苯 | ||
| C. | 有机物:橡胶、硅胶、纤维素、乙醇 | D. | 官能团:氯离子、羟基、硝基、苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷 | B. | 丙烯 | C. | 丁烷 | D. | 丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.1% | B. | 2.6% | C. | 0.46% | D. | 0.55% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水、过氧化氢和干冰都属于氧化物 | B. | H2SO4、HNO3、H2CO3都属于酸 | ||
| C. | 烧碱、纯碱、熟石灰都属于碱 | D. | NaHSO4、CuSO4和KMnO4都属于盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
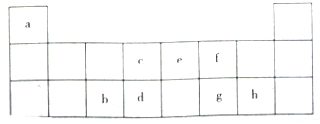 如该表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
如该表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题: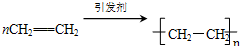 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com