
 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )| A、液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| B、液滴边缘是负极区,发生的电极反应为O2+2H2O+4e-═4OH- |
| C、液滴中的Cl-由b区向a区迁移 |
| D、若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、化学式相同,互为同分异构体 |
| B、具有相同的最简式,互为同系物 |
| C、具有相同的化学性质 |
| D、水解反应的最终产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CCl4可由CH4制得,可萃取碘水中的碘 |
| B、石油和天然气的主要成分都是碳氢化合物 |
| C、苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 |
| D、乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化剂与还原剂的物质的量之比为1:8 |
| B、还原产物为NH4+ |
| C、若有1 mol NO3-参加氧化反应,则转移8 mol电子 |
| D、该过程说明Fe(NO3)2溶液不宜加酸酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、提高反应限度 |
| B、降低反应限度 |
| C、增大反应速率 |
| D、减小反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体的分散质能透过滤纸 |
| B、胶体能产生丁达尔现象 |
| C、胶体是纯净物,其它分散系是混合物 |
| D、胶体的分散质粒子直径在1~100 nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
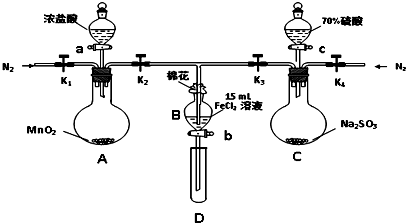
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com