
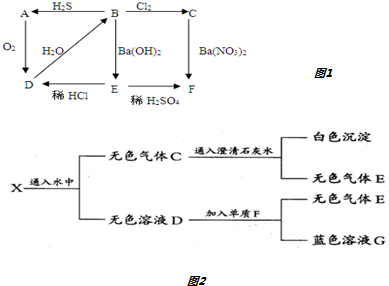
分析 (1)A为淡黄色固体,由转化关系可知A为S,D为SO2,与水反应生成的B为H2SO3,具有还原性,可与氯气发生氧化还原反应,则C为H2SO4,B和氢氧化钡反应生成E为BaSO3,F为BaSO4;
(2)黑色固体A加热至红热,投入到一种无色溶液B中,产生由两种气体组成的混合气体X,应是碳与浓硫酸或浓硝酸的反应,无色气体C通入澄清石灰水生成白色沉淀,该沉淀应为CaCO3,说明C中含有CO2,无色稀溶液D与单质F反应生成蓝色溶液,该溶液应含有Cu2+,则说明F为Cu,无色稀溶液D具有强氧化性,应为稀HNO3溶液,G为Cu(NO3)2,生成气体E为NO,则说明混合气体X应为CO2和NO2的混合物,则A为C,B为浓HNO3,无色气体C的成分为CO2、NO.
解答 解:(1)A为淡黄色固体,由转化关系可知A为S,D为SO2,与水反应生成的B为H2SO3,具有还原性,可与氯气发生氧化还原反应,则C为H2SO4,B和氢氧化钡反应生成E为BaSO3,F为BaSO4.
①由以上分析,可知A为S,D为SO2,E为BaSO3,
故答案为:S;SO2;BaSO3;
②B→C的化学方程式:Cl2+H2SO3+H2O=H2SO4+2HCl,
故答案为:Cl2+H2SO3+H2O=H2SO4+2HCl;
③B→A的化学方程式:2H2S+H2SO3=3S↓+3H2O,
故答案为:2H2S+H2SO3=3S↓+3H2O;
(2)黑色固体A加热至红热,投入到一种无色溶液B中,产生由两种气体组成的混合气体X,应是碳与浓硫酸或浓硝酸的反应,无色气体C通入澄清石灰水生成白色沉淀,该沉淀应为CaCO3,说明C中含有CO2,无色稀溶液D与单质F反应生成蓝色溶液,该溶液应含有Cu2+,则说明F为Cu,无色稀溶液D具有强氧化性,应为稀HNO3溶液,G为Cu(NO3)2,生成气体E为NO,则说明混合气体X应为CO2和NO2的混合物,则A为C,B为浓HNO3,无色气体C的成分为CO2、NO.
①由上述分析可知,C为CO2和NO,X为CO2和NO2,
故答案为:CO2和NO;
②A和B反应的方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
③稀硝酸和Cu反应的离子方程式为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,
故答案为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O.
点评 本题考查无机物的推断,是高频考点,这类题综合性强,对学生分析问题解决问题的能力要求高,要能在读题中快速发现解题突破点是解题关键,需要学生熟练掌握元素化合物知识,难度不大.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液滴加NaHSO4溶液至沉淀恰好完全:Ba 2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 用Pt 电极电解MgCl2溶液 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 往漂白粉溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | 苯酚钠溶液与氯化铝溶液反应 3C6H5O-+Al3++3H2O═3C6H5OH+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
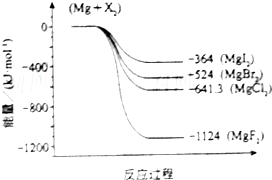 镁化合物和氯气均具有广泛用途,请回答下列问题:
镁化合物和氯气均具有广泛用途,请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com