
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A.烧碱、液态氧、碘酒 B.生石灰、白磷、熟石灰
C.干冰、铁、氯化氢 D.空气、氮气、胆矾
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注。
(1)已知:①2Cu(s)+1/2O2(g)=Cu2O(s) △H=-169kJ/mol
②C+1/2O2(g)=CO(g) △H=-110.5kJ/mol
③Cu(s)+1/2O2(g)=CuO(s) △H=-157kJ/mol
用炭粉在高温条件下还原CuO的方法制得纳米级Cu2O的热化学方程式为_______________。
(2)采用离子交换膜控制电解液中OH-的浓度也可以制备纳米级Cu2O,装置如图所示:
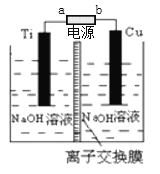
为保证电解能持续稳定进行,若电解槽中的离子交换膜只允许一种离子通过,则该交换膜应为_____ (填“Na+”或“H+”或“OH-”)离子交换膜,该电池的阳极反应式为_______。
(3)用Cu2O做催化剂,工业上在一定条件一下,可以用一氧化碳与氢气反应合成甲醇:
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)

①甲图是反反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=_________。
②乙图表示该反应进行过程中能量的变化。请在乙图中画出用Cu2O作催化剂时“反应过程——能量”示意图_________。
③温度升高,该反应的平衡常数K_____(填“增大”、“不变”或“减小”)。
④ 某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则该反应在该温度下的平衡常数为_____(保留一位有效数字)。相同温度下,若向上述2L密闭容器中加入4molCO、3molH2、1molCH3OH,反应开始时,v(正)____v(逆)(填“大于”、“小于”或“等于”)。
⑤ 在容积均为1L的a、b、c、d、e,5个密闭容器中都分别充入1molCO和2molH2的混合气体,控温。图丙表示5个密闭容器温度分别为T1~T5、反应均进行到5min时甲醇的体积分数,要使容器c中的甲醇体积分数减少,可采取的措施有___________。
⑥ 据研究,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是_______(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能在一定条件下能够转化为电能,构成原电池。
(1)根据构成原电池的本质判断,如下反应可以设计成原电池的是(填序号)______。
A.NaOH+HCl=NaCl+H2O B.Na2CO3+2HCl=2NaCl+H2O+CO2↑
C.2H2O=2H2↑+O2↑ D.Cu+2AgNO3=2Ag+Cu(NO3)2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验。有关实验现象,下列说法正确的是:_______(填序号)
A.图I和图II的气泡均产生在锌棒表面
B.图II中产生气体的速度比I快
C.图I中温度计的示数高于图II的示数
D.图I和图II中温度计的示数相等,且均高于室温

(3)大气污染越来越成为人们关注的问题.烟气中的NOx必须脱除(即脱硝)后才能排放。己知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=一890.3kJ·mol-l
N2(g)+O2(g)=2NO(g) △H=+180kJ·mol-1
CH4可用于脱硝,写出该反应热化学反应式________。
(4)如图是甲烷燃料电池原理示意图,回答下列问题:
①电他的负极反应式为:__________。

②电池工作一段时间后电解质溶液的pH________(填“增大”“减小”或“不变”)。
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池。试写出该电池的正极反应式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2NO+O2![]() 2NO2是放热反应.右图表示其他条件一定时,反应中NO的转化率与温度的关系曲线.图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
2NO2是放热反应.右图表示其他条件一定时,反应中NO的转化率与温度的关系曲线.图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )

A. a点 B. b点 C. c点 D. d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A 是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。

请回答下列问题:
(1)写出A的结构简式 。
(2)B、D分子中的官能团名称分别是 , 。
(3)物质B可以被直接氧化为D,需要加入的试剂是 。
(4)写出下列反应的化学方程式:
① ;反应类型: 。
④ ;反应类型: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CH3OH ( l )+NH3( g )═CH3NH2( g )+H2O ( g )在某温度自发向右进行,若反应|△H|=17kJ/mol,|△H﹣T△S|=17kJ/mol,对于该反应下列关系正确的是( )
A.△H>0,△H﹣T△S<0
B.△H<0,△H﹣T△S>0
C.△H>0,△H﹣T△S>0
D.△H<0,△H﹣T△S<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙晶体(CaO2·8H2O)常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
(1)过氧化钙晶体可用下列方法制备:
CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用如下制取装置制备过氧化钙晶体。
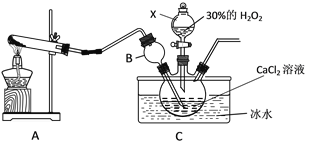
①装置A中发生反应的化学方程式为_______; 仪器X的名称为________。
②装置C采用冰水浴控制温度在0℃左右,可能的原因主要有:
Ⅰ.该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
Ⅱ.________________________
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验晶体已洗涤干净的操作为__________________。
(2)测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入2mol·L—1的硫酸溶液,充分反应。
步骤二:向上述锥形瓶中加入几滴__________溶液。
步骤三:逐滴加入浓度为c mol·L—1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出三次平均消耗Na2S2O3溶液体枳为V mL。产品中CaO2·8H2O的质量分数为_________ (用字母表示)[已知:I2+2S2O32-=2I-+ S4O62-]
(3)钙在空气中燃烧生成氮化钙(Ca3N2),同时可能会生成CaO2。请限用下列试剂,设计实验检验钙在空气中燃烧所得固体中是否含有CaO2:______________(简要说明实验步骤、现象和结论)。限用试剂:稀盐酸、MnO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电子云的叙述中,正确的是( )
A. 电子云形象地表示了电子在核外某处单位体积内出现的概率
B. 电子云直观地表示了核外电子的数目
C. 1s电子云界面图是一个球面,表示在这个球面以外,电子出现的概率为零
D. 电子云是电子绕核运动形成了一团带负电荷的云雾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,0.01mol/L NaOH的pH为10,该温度下将pH=5的强酸溶液和pH=8的强碱溶液混合后pH=7,则酸溶液体积和碱溶液体积比为( )
A. 1:10 B. 10:1 C. 9:2 D. 2:9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com