
【题目】下列四组离子中一定能大量共存的是 ( )
A. K+、H+、Cl﹣、CO32﹣ B. Fe3+、Mg2+、NO3﹣、SCN﹣
C. NO3﹣ H+、Fe2+、SO42﹣ D. Na+、OH﹣、Cl﹣、NO3﹣
科目:高中化学 来源: 题型:
【题目】ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒。我国最近成功研究出制取ClO2的新方法,其反应的微观过程如下所示:

下列有关该反应的叙述中正确的是( )
A.该反应是复分解反应
B.该反应的化学方程式为Cl2+2NaClO2===2ClO2+2NaCl
C.反应中Cl2既是氧化剂,又是还原剂
D.NaClO2和ClO2中Cl的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于吸热反应的是( )
A.Al与盐酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.NaOH与盐酸的反应
D.Na与H2O的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O,利用硼镁矿制取金属镁及粗硼的工艺流程如下,请回答下列有关问题:
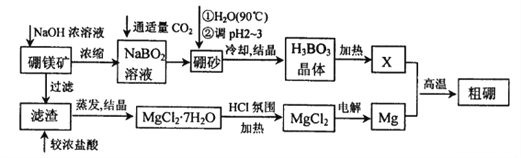
(1)硼砂中B的化合价为_________;滤渣的主要成分为_______________。
(2)X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为_________________________。
(3)H3BO3是一种一元弱酸,也可写作B(OH)3,它与水作用时结合水电离的OH-而呈酸性,这一变化的离子方程式为______________________________。
(4)MgCl2·6H2O需要在HCl氛围中加热,其目的是______________________。
(5)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.

(1)利用电化学原理将CO、SO2转化为重要化工原料,装置如图1所示:
①若A为CO,B为H2,C为CH3OH,则通入CO的为_________极(填“正”或“负”)。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为:___________________________。
(2)碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接做燃料,其工作原理如图2所示。
①电池总反应为____________________________________________。
②以此电源电解足量的硝酸银溶液,若阴极产物的质量为21.6g,电解后溶液体积为2L,溶液的pH约为___________。
(3)某研究小组利用下列装置用N2O4生产新型硝化剂N2O5。

①现以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。在该电极上同时还引入CO2的目的是__________________________。
②电解过程中,生成N2O5的电极反应方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水,废渣等进行有效检测与合理处理。某工厂对制革工业污泥中部的处理工艺流程如下:
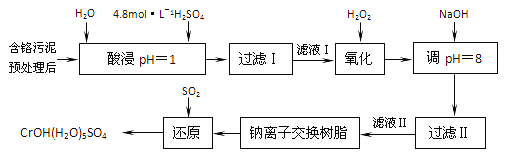
已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1) 酸浸时,为了提高浸取率可采取的措施有_________、___________。(答出两点)。
(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,则此反应中氧化剂和还原剂物质的量之比为_______。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) |
①用NaOH调节溶液的pH不能超过8,其理由是________________。
②当pH=8时,Mg2+是否开始沉淀(溶液中镁高子浓度不超过1mol·L-1)。____(填“是”或“否”(已知Ksp[Mg(OH)2]=1.8×10-11)。
(4)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O72-转化为CrO42-,写出上述流程中用SO2进行还原时发生反应的离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应均为吸热反应,其中一定不能自发进行的是
A. CO(g)=C(s)+ ![]() O2(g) B. 2N2O5(g)=4NO2(g)+O2(g)
O2(g) B. 2N2O5(g)=4NO2(g)+O2(g)
C. (NH4)2CO3(s)=NH4HCO3(s)+NH3(g) D. MgCO3(s)==MgO(s)+CO2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.01mol/L的NaOH溶液滴定某浓度的H2N2O2(二元弱酸)溶液,所得溶液中H2N2O2、HN2O2-、N2O22-三种微粒的物质的量分数(δ)与溶液PH的关系如图所示。则下列说法中正确的是
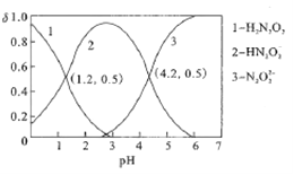
A. 该滴定过程应该选择甲基橙作为指示剂
B. Ka1(H2N2O2)的数量级为10-4.2
C. pH=1.2溶液中:c(Na+)+c(H+)=c(OH-)+c(H2N2O2)
D. pH=4.2溶液中:c(Na+)>2c(N2O22-)+c(HN2O2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com