
ijͬѧ��ʵ���Ҵ���ͼ��I����ǩ���Լ�ƿ��ȡ�����ƽ���ȼ��ʵ�飬��ͼ��II����

��1��װ�õ�����Ϊ____________��ʵ���У��۲쵽�ĵ���ɫ�Ĺ���������____________��д��ѧʽ�����۲쵽�Ļ�ɫ������___________Ԫ�صķ�����ס�
��2��ʵ����ֻ���������ɫ�������ɡ��ӷ�Ӧ�Pʵ������²⣺�ú�ɫ���ʿ���Ϊ̼����һ����������ɵĻ���
��������������___________��____________(д��ѧʽ����
��3���Ժ�ɫ�������ʵ��������ͼ��ʾ̽����

��ʵ��I�м��������Ŀ���ǣ�________��
�ڽ�ͨ��ʵ��II�������IJ����ܿ���ȷ����ɫ���ʵ���ɣ������Ƹ���ơ�
����ѡ�Լ���ϡ���ᡢKSCN��Ũ��K3[Fe(CN)6] ��Һ��l0����H2O2��Һ��

 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д� ����������ϵ�д�
����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�鱦�и�����ѧ��9���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
NA��ʾ�����ӵ�������ֵ�������й�˵����ȷ����
A��1.8 g H2O2������������ΪNA
B��1 L 1 mol/L�ļ״�ˮ��Һ�к�����ԭ������Ϊ4NA
C��12 gʯī��C60�Ļ��������������Ϊ6NA
D����ӦKIO3��6HI===KI��3H2O��3I2�У�����1 mol I2ת�Ƶ��ӵ�����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��㶫ʡ����У������ѧ�ڵ�һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ����ӵ�������������������ȷ����( )
A��46 g NO2 �� N2O4��������к���ԭ����Ϊ3NA
B����״���£�22.4 LSO3��ˮ��Ӧ����1mol����
C��1L 1mol/L������Һ����������Ϊ2NA
D������ͭ��18mol��L��1 1LŨ���ᷴӦ���Եõ�SO2�ķ�������Ϊ9NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��㶫ʡ�����и�����ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�л���Ľṹ��ʽΪ ������һ�������¿��ܷ����ķ�Ӧ�ǣ� ��
������һ�������¿��ܷ����ķ�Ӧ�ǣ� ��
�ټӳɣ���ˮ�⣻�������������������кͣ�����ȥ����ԭ
A���٢ۢܢݢޢ� B���٢ۢܢݢ�
C���٢ۢݢޢ� D���ڢۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��㶫ʡ�����и�����ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ���ǣ� ��
A������ϩ��ʹ���Ը��������Һ��ɫ
B��������������ͭ����Һ���Լ������ᡢ�����Ǻ͵���������Һ
C���������Ҵ���������Ӧ�����������Ȼ������Ҵ����ǻ��������ˮ
D��C3H8�Ķ��ȴ�����3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������ѧ��9.18�ܿ���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��2H2(g)+O2(g)=2H2O(g) ��H1
H2(g)+Cl2(g)=2HCl (g) ��H2
4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ��H3
N2(g)+3H2(g)=2NH3(g) ��H4
2NH3(g)+3Cl2(g)= N2(g)+6HCl(g) ��H5
���й���������Ӧʼ����ж���ȷ����( )
A����H1��0����H2>0 B����H3��0����H4>0 C����H2=��H4+��H5 D����H3=��H1-2��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������ѧ��9.18�ܿ���ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ�У���Ӧ�������������ص���( )
A������ͨ�����ȵ�CuO��ĩ B��������̼ͨ��Na2O2��ĩ
C������Fe2O3�������ȷ�Ӧ D����п��Ͷ��Cu(NO3)2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������ѧ��һ�����Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��Cl2ͨ������KOH��Һ�������п�����KCl��kClO��KClO3����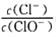 ��ֵ���¶ȸߵ��йأ���n(KOH)=amolʱ�������й�˵��������ǣ� ��
��ֵ���¶ȸߵ��йأ���n(KOH)=amolʱ�������й�˵��������ǣ� ��
A����ij�¶��£���Ӧ��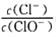 =11������Һ��
=11������Һ��
B���μӷ�Ӧ�����������ʵ�������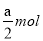
C���ı��¶ȣ�������ת�Ƶ��ӵ����ʵ���n�ķ�Χ��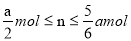
D���ı��¶ȣ�������KClO3��������۲���Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�����и�����ѧ��9���¿���ѧ�Ծ��������棩 ���ͣ������
�� 3mol A �� 2.5mol B ����� 2L ���ܱ������У�ʹ���Ƿ�����Ӧ��3A(��) + B(��)  xC(��) + 2D(��)����5min��ﵽƽ������1mol D�����ⶨC��ƽ������Ϊ0.1 mol/��L��min������˷�Ӧ�е�B��ת����Ϊ________��C��ϵ��Ϊ_______________��A��ƽ��Ũ��Ϊ_____________��
xC(��) + 2D(��)����5min��ﵽƽ������1mol D�����ⶨC��ƽ������Ϊ0.1 mol/��L��min������˷�Ӧ�е�B��ת����Ϊ________��C��ϵ��Ϊ_______________��A��ƽ��Ũ��Ϊ_____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com