A��B��C��D��E���ֶ�����Ԫ�أ�ԭ��������������AԪ�ص�ԭ�Ӱ뾶��С����AΪ��Ԫ�أ�BԪ��ԭ�ӵ��������������ڲ��������2������B��2�����Ӳ㣬����������Ϊ4����BΪ̼Ԫ�أ�CԪ�ص�����������ˮ����X�����⻯�ﷴӦ����һ����Y����CΪ��Ԫ�ء�XΪ���ᡢYΪ����泥�A��Eͬ���壬E��ԭ����������̼Ԫ�أ���EΪNaԪ�أ�A��B��C��E����Ԫ�ض�����DԪ���γ�ԭ�Ӹ����Ȳ���ͬ�ij����������DΪO��Ԫ�أ�
��1�������£�������Һ��ˮ������������Ũ�ȵ�����Һ������������Ũ��Ϊ
mol/L=10
-9mol/L���������Һ��������Ϊˮ��������ģ�������Ũ��Ϊ10
-5mol/L��������Һ����ˮ�������H
+Ũ��֮��Ϊ10
-9mol/L��10
-5mol/L=10
-4��1��
�ʴ�Ϊ��10
-4��1��
��2��A��B��D��E����Ԫ����ɵ�ij������������ֽ⣬�û�����ΪNaHCO
3������NaHCO
3��Һ��������Ba��OH��
2��Һ��Ӧ����̼�ᱵ��̼�������ǣ���Ӧ�����ӷ���ʽΪ��Ba
2++HCO
3-+OH
-�TBaCO
3��+H
2O��
�ʴ�Ϊ��Ba
2++HCO
3-+OH
-�TBaCO
3��+H
2O��
��3������Ƭ��þƬ�õ�������������NaOH��ϡ��Һ�й���ԭ��أ���������������Һ��Ӧ��Mg��������������Һ��Ӧ����AlΪ�������缫��ӦʽΪAl+4OH
-�TAlO
2-+2H
2O+3e
-��
�ʴ�Ϊ��Al+4OH
-�TAlO
2-+2H
2O+3e
-��
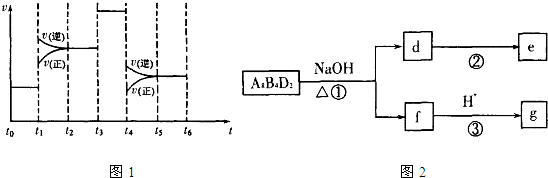
��4��t
0��t
1�����淴Ӧ������ȣ�����ƽ��״̬��t
1��t
2�����淴Ӧ���ʶ��������淴Ӧ���ʴ�������Ӧ���ʣ�ƽ�����淴Ӧ�����ƶ�������CA
3�ĺ������ͣ�t
2��t
3�����淴Ӧ������ȣ�����ƽ��״̬��CA
3�ĺ������䣻t
3��t
4�����淴Ӧ���ʶ�ͬ�ȳ̶ȵ�����ƽ�ⲻ�ƶ���CA
3�ĺ������䣻t
4��t
5�����淴Ӧ���ʶ����ͣ����淴Ӧ���ʴ�������Ӧ���ʣ�����ƽ�����淴Ӧ�����ƶ���CA
3�ĺ������ͣ�t
5��t
6�����淴Ӧ������ȣ�ƽ�ⲻ�ƶ���CA
3�ĺ������䣬����ƽ��������CA
3�ĺ�����ߵ�һ��ʱ����t
0��t
1��
3A
2��g��+C
2��g��?2CA
3��g��
��ʼ��mol/L����4a 2a 0
�仯��mol/L����3a a 2a
ƽ�⣨mol/L����a a 2a
�ʸ��¶�ƽ�ⳣ��k=
=
�ʴ�Ϊ��t
0��t
1��
��
��5��������H
8C
4O
2�ڼ��������µõ�f��f�ữ�õ�g��g�dz��õ�ζƷ����Ҫ�ɷ֣�������ΪCH
3COOC
2H
5��fΪ�����ƣ���Ӧ�ٵĻ�ѧ����ʽΪCH
3COOC
2H
5+NaOH
CH
3COONa+CH
3CH
2OH��
dΪ�Ҵ����Ҵ����������Եõ���ȩ������Ϊ��ȡһ�����ͭ˿�Ƴ�����״�����ھƾ���������ȣ�Ȼ������d�У��������Σ��۲쵽ͭ˿�ɺ���ڡ��죬���ŵ�Һ���д̼�����ζ��
�ʴ�Ϊ��CH
3COOC
2H
5+NaOH
CH
3COONa+CH
3CH
2OH��ȡһ�����ͭ˿�Ƴ�����״�����ھƾ���������ȣ�Ȼ������d�У��������Σ��۲쵽ͭ˿�ɺ���ڡ��죬���ŵ�Һ���д̼�����ζ��














 Ԫ�����ڱ������ڵ�һ���������ʾ�������й�A��B��C��D��E����Ԫ�ص������У���ȷ���ǣ�������
Ԫ�����ڱ������ڵ�һ���������ʾ�������й�A��B��C��D��E����Ԫ�ص������У���ȷ���ǣ�������