
(10��) ������һ����Ҫ�Ļ���ԭ�ϣ���ҵ����N2��H2�ϳ�NH3������֪N2(g)��H2(g)��Ӧ����1 mol NH3(g)�����������仯ʾ��ͼ������ͼ���ش��������⣺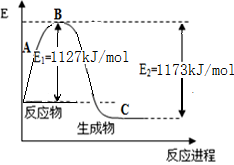
��1���÷�ӦΪ (����ȡ����ȡ�)��Ӧ��
��2���ϳɰ����Ȼ�ѧ����ʽΪ ��
��3��������֪�����������ϱ�����������������N-H������Ϊ kJ/mol��
��4����ҵ�ϣ�����Ϊԭ����������ĵ�һ��Ϊ������������д���÷�Ӧ�Ļ�ѧ����ʽ ��
��1������ ��2��N2(g)+3H2(g) 2 NH3(g) ��H����92 kJ/mol
2 NH3(g) ��H����92 kJ/mol
��3��391 ��4�� 4NH3 + 5O2  4NO + 6H2O ��
4NO + 6H2O ��
���������������1�����ڷ�Ӧ����������������������������ʵ�����������ͷų�������˸÷�Ӧ�Ƿ��ȷ�Ӧ����2������ͼʾ��֪���ϳɰ����Ȼ�ѧ����ʽΪN2(g)+3H2(g) 2 NH3(g) ��H����92 kJ/mol����3����Ӧ�Ⱦ��Ƕ��ѻ�ѧ�����յ��������γɻ�ѧ���ͷŵ������IJ436 kJ/mol��3mol+946 kJ/mol��1mol-6X=��92 kJ/mol,���X=391 kJ/mol����4����ҵ�ϣ�����Ϊԭ����������ĵ�һ��Ϊ�����������÷�Ӧ�Ļ�ѧ����ʽ��4NH3 + 5O2
2 NH3(g) ��H����92 kJ/mol����3����Ӧ�Ⱦ��Ƕ��ѻ�ѧ�����յ��������γɻ�ѧ���ͷŵ������IJ436 kJ/mol��3mol+946 kJ/mol��1mol-6X=��92 kJ/mol,���X=391 kJ/mol����4����ҵ�ϣ�����Ϊԭ����������ĵ�һ��Ϊ�����������÷�Ӧ�Ļ�ѧ����ʽ��4NH3 + 5O2  4NO + 6H2O��
4NO + 6H2O��
���㣺���鷴Ӧ����ЧӦ����Ӧ������ܡ����ʵ������Ĺ�ϵ����ѧ����ʽ���Ȼ�ѧ����ʽ����д��֪ʶ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��12�֣���1���������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���Ӧ��2H2 + O2 = H2O�� ��֪�÷�ӦΪ���ȷ�Ӧ����ͼ����ȷ��ʾ�÷�Ӧ�������仯����________��
�Ӷϼ��ͳɼ��ĽǶȷ���������Ӧ�������ı仯����ѧ���ļ������±���
| ��ѧ�� | H��H | O��O | H��O |
| ����kJ/mol | 436 | 496 | 463 |
 xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L����1min�ڣ�B��ƽ����Ӧ����Ϊ ��XΪ ������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ�� 0.8mol/L������ڣ�С�ڻ���ڡ���������֪��ƽ��ʱ���������ڻ��������ѹǿΪp�����������ʼѹǿΪp0������p0��p����ʾ��ƽ��ʱ��Ӧ��A��ת����Ϊ ��
xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L����1min�ڣ�B��ƽ����Ӧ����Ϊ ��XΪ ������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ�� 0.8mol/L������ڣ�С�ڻ���ڡ���������֪��ƽ��ʱ���������ڻ��������ѹǿΪp�����������ʼѹǿΪp0������p0��p����ʾ��ƽ��ʱ��Ӧ��A��ת����Ϊ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��16�֣���Ⱦ�����Чȥ������Դ�ij�������ǻ�ѧ�츣�������Ҫ�о����⡣ij��ѧ�о�С���������̿���Ҫ�ɷ�ΪMnO2������������ͷ��������ͭ�����Ƚ�����������������ͨ�����¼����̼��ѳ�ȼúβ���е�SO2�����Ƶõ�ز���MnO2����Ӧ��������ȥ����
��ش��������⣺
��1��������������ʵ����____��ѡ��������ĸ��ţ���
A����������ۺ����� B����ɫ��Ⱦ�ļ��� C������ļ���
��2����MnCO3�ܳ�ȥ��Һ��Al3����Fe3������ԭ����_____��
��3����֪��25�桢101kpaʱ��Mn(s)��O2(g)��MnO2(s) ��H����520kJ/mol
S(s)��O2(g)��SO2(g) ��H����297kJ/mol
Mn(s)��S(s)��2O2(g)��MnSO4(s) ��H����1065kJ/mol
SO2��MnO2��Ӧ������ˮMnSO4���Ȼ�ѧ����ʽ��________________��
��4��MnO2�����������������ϡ��ö��Ե缫���MnSO4��Һ���Ƶ�MnO2���������ĵ缫��Ӧʽ��
_ _��
��5��MnO2�Ǽ���п�̵�ص��������ϡ�����п�̵�طŵ�ʱ�������ĵ缫��Ӧʽ��______��
��6�������ѳ���SO2ֻ�����̿��е�MnO2��Ӧ������ͼʾ���̣���a m3����״������SO2���������Ϊb%��β��ͨ�����SO2���ѳ���Ϊ89.6%�����յõ�MnO2������Ϊc kg�����ȥ��������ͭ����������ʱ�����������Ԫ���൱��MnO2___________kg��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��14�֣������ѣ�CH3OCH3���ͼ״���CH3OH�����Ǹ�Ч�����Դ����ҵ������ú���������ˮú�����ϳɼ״��Ͷ����ѡ��ش��������⣺
��1���Ʊ����������һ����Ӧ��Al2O3���״���ˮ�ϳɣ���Ӧ����ʽΪ ��
��2����֪��CO(g)+2H2(g)=CH3OH (g) ��H= ��90.1kJ��mol-1 CO(g)��ȼ������282.8 kJ��mol-1��H2��ȼ������285.8 kJ��mol-1д����ʾCH3OH (g) ȼ���ȵ��Ȼ�ѧ��Ӧ����ʽ ��
��3��������ֱ��ȼ�ϵ�رȼ״�ֱ��ȼ�ϵ�ظ���Ч���������Ķ����Ѻͼ״���ȫ�ŵ�ת�Ƶ��ӵ����ʵ���֮���� ���ö�����ֱ��ȼ�ϵ�ص����������ʳ��ˮ��������9.2g������ʱ������������������������Ϊ L��������£�
��4���ںϳ��а���ˮú��������Ӧ��CO(g)+H2O(g)  CO2(g)+H2(g)�������ʵ�����CO(g)��H2O(g)�����ܱ������з�Ӧ��ƽ��ʱ��ý�����±���
CO2(g)+H2(g)�������ʵ�����CO(g)��H2O(g)�����ܱ������з�Ӧ��ƽ��ʱ��ý�����±���
| �¶� | 260�� | 280�� | 295�� | 310�� |
| COת���� | 89% | 80% | 75% | 60% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������ȼ��ʱ�ܷų��������ȣ���Ҳ��Һ��ʯ��������Ҫ�ɷ֣���Ϊ��ԴӦ�������ǵ��ճ������������֪��
��2C3H8(g)��7O2(g) =6CO(g)��8H2O(g) ��H =��2389.8 kJ/mol
��2CO(g) + O2(g) =2CO2(g) ��H =��566 kJ/mol
��H2O(l) = H2O(g) ��H ="+" 44.0 kJ/mol
��1��д��C3H8ȼ��ʱȼ���ȵ��Ȼ�ѧ����ʽ ��
��2��C3H8�ڲ�������������ȼ�գ�����CO��CO2��H2O(g)�������еIJ���ͨ��һ������̶����ܱ������У���һ�������·������¿��淴Ӧ��CO(g) +H2O(g)  CO2(g) +H2(g)�÷�Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���±���
CO2(g) +H2(g)�÷�Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���±���
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
| | H2O | CO | CO2 | H2 |
| �� ������/g�� | 1.8 | 8.4 | a | 1 |
| �� ������/g�� | 1.8 | 2.8 | 0 | 0 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����ǵ�ѭ���е���Ҫ���ʣ�����������������������Ź㷺��Ӧ�á�
��1����ͼ��N2��H2��Ӧ�����������仯��ʾ��ͼ����÷�Ӧ����Һ̬�����Ȼ�ѧ����ʽ�� ��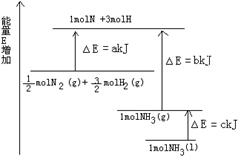
��2����֪����H2O(g)=H2O(l) ��H����Q1 kJ��mol��1
��C2H5OH(g)��3O2(g)=2CO2(g)��3H2O(g) ��H����Q2 kJ/mol ��C2H5OH(g)=C2H5OH(l) ��H����Q3 kJ/mol
��23 gҺ��ƾ���ȫȼ������CO2(g)��H2O(l)���ͷų�������Ϊ kJ������Q1��Q2��Q3����ʾ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)��֪���������Ȼ�ѧ����ʽ��
C3H8(g)+5O2(g) =3CO2(g)+4H2O(l) ��H=��2220.0 kJ��mol-1
H2O��l��=H2O��g�� ��H="+44.0" kJ��mol-1
��0.5mol����ȼ������CO2����̬ˮʱ�ͷŵ�����Ϊ ��
(2)��֪��TiO2(s)��2Cl2(g)=TiCl4(l)��O2(g) ��H����140 kJ��mol��1
2C(s)��O2(g)="2CO(g)" ��H����221 kJ��mol��1
д��TiO2�ͽ�̿��������Ӧ����TiCl4��CO������Ȼ�ѧ����ʽ�� ��
(3)��ѧ���ѻ���˼��������о������N4���ӣ���ṹΪ�������壨��ͼ��ʾ��������������ơ���֪����1molN��N������193kJ����������1molN N������941kJ��������1molN4����ת��Ϊ2molN2ʱҪ�ų� kJ������
N������941kJ��������1molN4����ת��Ϊ2molN2ʱҪ�ų� kJ������
��4������������ɴ���ʹ�õ�������ȼ�ϵ�أ������ܷ�ӦΪ��2H2+O2��2H2O���������ҺΪϡH2SO4��Һ����طŵ�ʱ�ǽ� ��ת��Ϊ �ܡ���缫��Ӧʽ�ֱ�Ϊ������ ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ס�������������ͬ�������壬�ڿ�����ȼ�յõ����������������ʱ����P4O6����������ʱ����P4O10��
(1)��֪298 Kʱ���ס�������ȫȼ�յ��Ȼ�ѧ����ʽ�ֱ�Ϊ
P4(s������)��5O2(g)===P4O10(s) ��H1����2 983.2 kJ��mol��1
P(s������)�� O2(g)===
O2(g)=== P4O10(s) ��H2����738.5 kJ��mol��1
P4O10(s) ��H2����738.5 kJ��mol��1
����¶��°���ת��Ϊ�����Ȼ�ѧ����ʽΪ ��
(2)��֪298 Kʱ���ײ���ȫȼ�յ��Ȼ�ѧ����ʽΪP4(s������)��3O2(g)===P4O6(s) ��H����1638 kJ��mol��1����ij�ܱ������м���62 g����50.4 L����(��״��)����������ʹ֮ǡ����ȫ��Ӧ�������õ���P4O10��P4O6�����ʵ���֮��Ϊ ����Ӧ�����зų�������Ϊ ��
(3)��֪����PCl3�ķ��ӽṹ��ͼ�����ṩ���»�ѧ���ļ���(kJ��mol��1)��P��P 198��Cl��Cl 243��P��Cl 331��
��ӦP4(s������)��6Cl2(g)===4PCl3(s)�ķ�Ӧ�Ȧ�H�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����̼��̼�Ļ����������������������е�Ӧ�÷dz��㷺������̼�������ֻ��һ�����룬����һ��ֵ���ڴ������ʽ��
��1������ȼ��ʱ�ų��������ȣ�����Ϊ��ԴӦ������������������ 
��2��������ʯī�缫����KOH��Һ�У��������ֱ�ͨ��CH4��O2�����ɼ���ȼ�ϵ�ء��为���缫��Ӧʽ�ǣ� ��
��3������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�Ӧ��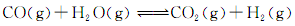 ���õ������������ݣ�
���õ������������ݣ�
��ʵ��1�У���v�� H2����ʾ��ƽ����Ӧ����Ϊ�� ��
�ڸ÷�Ӧ������ӦΪ ��������š����ȷ�Ӧ��
����Ҫʵ��3�ﵽ��ʵ��2��ͬ��ƽ��״̬���������ʵ���������ֱ���ȣ�����a��bӦ����Ĺ�ϵ�� ���ú�a��b����ѧʽ��ʾ����
����ijС�����ù�ҵ�����ӽ���Ĥ�����ռ��ԭ����������ͼ��ʾװ�õ��K2SO4��Һ��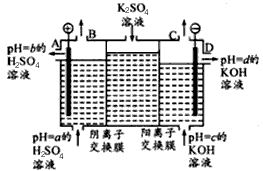
�ٸõ�����ͨ�������ӽ���Ĥ�������� ���>����<����һ����ͨ�������ӽ���Ĥ����������
��ͼ��a��b��c��d�ֱ��ʾ�й���Һ��pH����a��b��c��d��С�����˳��Ϊ ��
�۵��һ��ʱ���B������C���ڲ��������������Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com