
【题目】下列说法正确的是
A.在常温常压下,11.2LN2所含有的分子数为0.5NA
B.在标准状况下, 22.4 L CO和N2的混合物的物质的量为1mol
C.在标准状况下, 18g H2O的体积为22.4 L
D.1mol SO2的体积为22.4 L
科目:高中化学 来源: 题型:
【题目】下列物质转化关系如图所示,反应过程中部分产物可能已略去。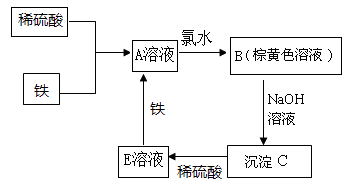
请回答以下问题:
(1)E溶液中溶质的化学式为。若将沉淀C加热至恒重,最终得到的物质是。
(2)A溶液中滴加入NaOH溶液,振荡,放置一段时间,可以观察到的现象是 , 发生反应的化学方程式有。
(3)若在酸性的A溶液中通入氧气,也能得到棕黄色溶液,请写出此反应的离子方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置(夹持仪器己略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下移动①中铜丝可控制SO2的产生与停止
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认有CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将22.4g铜和三氧化二铁的混合粉末加入到溶液为1mol/L的硫酸中,使之发生反应.
(1)若固体恰好全部溶解,消耗硫酸的体积为VL,则V的取值范围为 .
(2)若硫酸溶液过量,反应后的溶液体积为1L,测得此溶液中Fe2+浓度为0.1mol/L,则原混合物中含铜g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃ 时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( ) 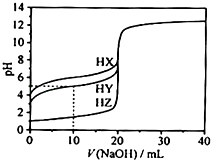
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10﹣5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X﹣)>c(Y﹣)>c(OH﹣)>c(H+)
D.HY与HZ混合,达到平衡时:c(H+)═ ![]() +c(Z﹣)+c(OH﹣)
+c(Z﹣)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中物质的量浓度为1mol/L的是
A.将40gNaOH 溶解在1L水中
B.将22.4LHCl气体溶于水配成1 L溶液
C.将1L 10 mol/L的浓盐酸加入9 L水中
D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在强碱性溶液中可以大量共存的是
A.I-、AlO2-、H+、S2-B.Na+、K+、NH4+、Ba2+
C.Br-、S2-、Cl-、CO32-D.SO32-、NO3-、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)2.3g 乙醇含有个H原子,所含共价键的物质的量 , 其中所含官能团羟基的电子数为 .
(2)某条件下,8g氧气所占的体积为6L,则在该条件下的气体摩尔体积为 .
(3)100mL硫酸铝溶液中C(Al3+)=0.20mol/L(不考虑水解因素),则其中n(SO42﹣)= .
(4)在9.5g某二价金属的氯化物中含有0.2mol Cl﹣ , 此氯化物的摩尔质量为 .
(5)6.72L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量为 g,转移的电子数目为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图1所示.已知 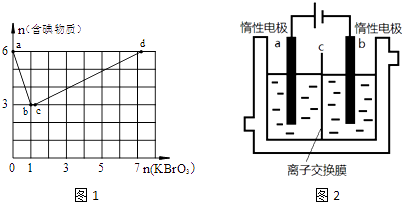
①BrO3﹣+6I一+6H+=3I2+Br﹣+3H2O;
②2BrO3﹣+I2=2IO3﹣+Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 , 还原产物是 .
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 .
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由 .
(4)含6mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 .
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图2所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.阳极的电极反应式为;阴极观察到的现象是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com