
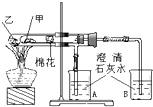
 如图是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察如图实验装置、分析实验原理,并判断下列说法和做法,其中不科学的是( )
如图是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察如图实验装置、分析实验原理,并判断下列说法和做法,其中不科学的是( )| A、甲为小苏打,乙为纯碱 |
| B、整个实验过程中没有发现A烧杯的澄清石灰水变浑浊 |
| C、加热不久就能看到A烧杯的澄清石灰水变浑浊 |
| D、要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、明矾-Al2 (SO4)3 |
| B、苛性钠-Na2O2 |
| C、小苏打-NaHCO3 |
| D、生石灰-Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3或Na2CO3粉末同时倒入试管中,观察到现象如下:
(1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3或Na2CO3粉末同时倒入试管中,观察到现象如下:| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 35mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 2.5g Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10mL水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 2.5g Na2CO3固体 | 20℃ | 25.1℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AlCl3溶液中滴入NaOH溶液 |
| B、向NaOH溶液中通入SO2气体 |
| C、向稀硝酸中加入过量铁粉 |
| D、向Na2CO3溶液中滴入盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N和P是植物营养素,海洋或湖泊中N、P含量越高越有利于水生动植物的生长 |
| B、只要不喝被重金属污染的水就不会中毒,因此水中的重金属污染对人类影响不大 |
| C、用熟石灰处理钢铁厂的酸性废水,利用的是复分解反应原理 |
| D、用Na2S处理含Hg2+废水使Hg2+变成HgS沉淀而除去,利用的是氧化还原反应原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 “套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.请观察下列实验装置,分析实验原理,并回答下列问题:
“套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.请观察下列实验装置,分析实验原理,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com