
(化学与技术,15分)微生物对人类有着各种各样的用途,现在生物工程学家利用微生物从矿石中提取金属。铜是一种很有价值的金属,可以从铜矿中提取。微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石,把不溶性的硫化铜转化成可溶的硫酸铜。利用细菌提取铜的生产过程:在已有细菌存在的岩石、矿石堆中,喷洒酸水以促进细菌生长;在它们的生长过程中,氧化而成的硫酸铜形成低浓度的溶液流到矿石堆的底部,再从这种溶液中提取金属铜。水循环使用,再回到矿石堆中。在美国,10%的铜是用这种方法生产的。
试回答下列问题:
(1)细菌把硫化铜氧化为硫酸铜的过程中起了什么作用:
(2)从硫酸铜溶液中提取铜,简便而经济的方法是 ;相应的化学方程式为: 。
(3)普通生产铜的方法是在空气中燃烧硫化铜(产物中有一种气态氧化物)。试比较两种方法的优缺点。
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制成单质铜,有人设计以下两种方案:①FeH2Cu ②CuOCuSO4Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是 ( )
A.①多 B.②多 C.相等 D.无法判断
(5)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为____________.电解粗铜制取精铜,电解时,阳极材料是__________,电解液中必须含有的阳离子是________.
(6)工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO+2HCl===CuCl2+H2O FeO+2HCl===FeCl2+H2O
已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完 全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是
(1)催化作用 (2)向硫酸铜溶液中加入废铁,将铜置换出来;Fe+CuSO4=FeSO4+Cu
(3)普通方法煅烧硫化铜,产生烟尘和SO2气体污染环境。生物工程更有优点,它的优点是成本低、效益好,环境污染程度小。
(4) B (5) Cu2S、O2 粗铜 (6) 先将Fe2+氧化成Fe3+,再调整pH在3~4
【解析】
试题分析:(1)细菌把硫化铜氧化为硫酸铜的过程中,并未参与反应,起催化作用(2)利用废铁进行置换,既简便又经济。Fe+CuSO4=FeSO4+Cu
(3)普通方法煅烧硫化铜,产生烟尘和SO2气体污染环境。生物工程更有优点,它的优点是成本低、效益好,环境污染程度小。
考点:铜的化学性质,电解池,铁离子的化学性质。
点评:本题属于综合大体,信息量大,知识点多。做这类题目时,要大题小做,逐一击破。每个小题涉及的知识点不用,就利用不用的化学知识和化学原理去解答。


科目:高中化学 来源: 题型:
【化学选修2:化学与技术】(15分)
工业上为了使原料和能量得到充分的利用,常常采用循环操作。
I、利用热化学循环制氢能缓解能源矛盾。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。MnFe2O4的制备:
已知Fe3+、Mn2+沉淀的pH如右表所示。
|
| 开始沉淀 | 完全沉淀 |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
(1)此工艺中理论上投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比应为 。
(2)控制pH的操作中m的值为 。
II、用MnFe2O4热化学循环制取氢气:
(3)由上可知,H2燃烧的热化学方程式是 。
(4)该热化学循环制取氢气的优点是 (填字母编号)。
A.过程简单、无污染 B.物料可循环使用
C.氧气和氢气在不同步骤生成,安全且易分离
III、工业上可用H2、HCl通过下图的循环流程制取太阳能材料高纯硅。
反应①
反应②:
(5)上图中,假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率和反应②中H2的利用率均为75%。则在下一轮次的生产中,需补充投入HCl和H2的体积比是 。
查看答案和解析>>
科目:高中化学 来源:2013届辽宁省铁岭市六校协作高三第三次联合考试化学试卷(带解析) 题型:填空题
(化学与技术,15分)微生物对人类有着各种各样的用途,现在生物工程学家利用微生物从矿石中提取金属。铜是一种很有价值的金属,可以从铜矿中提取。微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石,把不溶性的硫化铜转化成可溶的硫酸铜。利用细菌提取铜的生产过程:在已有细菌存在的岩石、矿石堆中,喷洒酸水以促进细菌生长;在它们的生长过程中,氧化而成的硫酸铜形成低浓度的溶液流到矿石堆的底部,再从这种溶液中提取金属铜。水循环使用,再回到矿石堆中。在美国,10%的铜是用这种方法生产的。
试回答下列问题:
(1)细菌把硫化铜氧化为硫酸铜的过程中起了什么作用:
(2)从硫酸铜溶液中提取铜,简便而经济的方法是 ;相应的化学方程式为: 。
(3)普通生产铜的方法是在空气中燃烧硫化铜(产物中有一种气态氧化物)。试比较两种方法的优缺点。
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制成单质铜,有人设计以下两种方案:①FeH2Cu ②CuOCuSO4Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是 ( )
| A.①多 | B.②多 | C.相等 | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:(教师解析专用)2009~2010学年银川二中高三模拟(二)试题理综化学 题型:填空题
【化学选修2:化学与技术】(15分)
工业上为了使原料和能量得到充分的利用,常常采用循环操作。
I、利用热化学循环制氢能缓解能源矛盾。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。MnFe2O4的制备:
已知Fe3+、Mn2+沉淀的pH如右表所示。
| | 开始沉淀 | 完全沉淀 |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
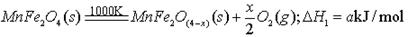
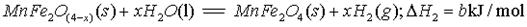
 (填字母编号)。
(填字母编号)。 B.物料可循环使用
B.物料可循环使用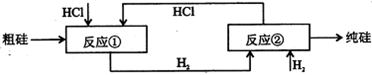
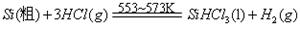
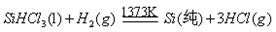
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省保定市高三上学期期末调研考试理科综合化学试卷(解析版) 题型:填空题
【化学――选修化学与技术】(15分)
氨在国民经济中占有重要地位,下图是合成氨的简要流程:

I.原料气的制备:
(1) 合成氨所需氮气来自空气,方法之一是将空气液化后再加热分馆;请另设计一种从空气中分离出氮气的方法:_________________________________________________________;
(2) 请写出工业上获得氢气的一种方法(用化学方程式表示)____________
II.原料气的净化:、
为防止催化剂“中毒”,原料气在进人压缩机之前必须经过净化、精制处理,“精制”过程通常是将含有少量CO、CO2、O2和H2S等杂质的原料气体通入含有氨水的醋酸亚铜二氨( )溶液,以获得纯净原料气。其中,吸收CO的反应为:
)溶液,以获得纯净原料气。其中,吸收CO的反应为:

(3) 为提髙CO吸收率,可采取的有效措施是__________________
(4) 除去氧气时,氧气将 氧化为
氧化为 ,则反应中还原剂与氧化剂的物质的量之比是____________;
,则反应中还原剂与氧化剂的物质的量之比是____________;

III.氨的合成:
(5)据报道,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了髙温常压下高转化率的电化学合成氨。其实验装置如图。请写出钯电极A上的电极反应式________________________
查看答案和解析>>
科目:高中化学 来源:2009-2010学年银川二中高三模拟(二)试题理综化学 题型:填空题
【化学选修2:化学与技术】(15分)
工业上为了使原料和能量得到充分的利用,常常采用循环操作。
I、利用热化学循环制氢能缓解能源矛盾。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。MnFe2O4的制备:

已知Fe3+、Mn2+沉淀的pH如右表所示。
|
|
开始沉淀 |
完全沉淀 |
|
Fe3+ |
2.7 |
4.2 |
|
Mn2+ |
8.3 |
10.4 |
(1)此工艺中理论上投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比应为 。
(2)控制pH的操作中m的值为 。
II、用MnFe2O4热化学循环制取氢气:


(3)由上可知,H2燃烧的热化学方程式是 。
(4)该热化学循环制取氢气的优点是 (填字母编号)。
A.过程简单、无污染 B.物料可循环使用
C.氧气和氢气在不同步骤生成,安全且易分离
III、工业上可用H2、HCl通过下图的循环流程制取太阳能材料高纯硅。

反应①
反应②:
(5)上图中,假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率和反应②中H2的利用率均为75%。则在下一轮次的生产中,需补充投入HCl和H2的体积比是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com