
| A. | 在含铁元素较多的酸性土壤中 | |
| B. | 在干燥致密不透气的土壤中 | |
| C. | 在潮湿疏松透气的土壤中 | |
| D. | 在含碳粒较多的潮湿透气的中性土壤中 |
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | |
| B. | 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小 | |
| C. | 1 mol-CH3 含有9 mol 电子 | |
| D. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
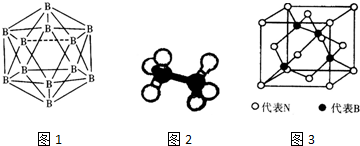
 ,核外有5种运动状态不同的电子.
,核外有5种运动状态不同的电子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日用品中的塑料、橡胶、糖类等都是有机物 | |
| B. | 生活中经常使用的保鲜膜主要成分是聚乙烯 | |
| C. | 氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂 | |
| D. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:4 | D. | 2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com