
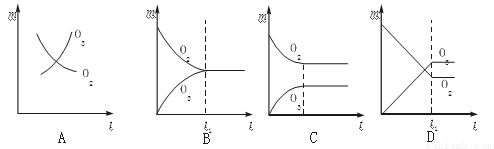
将3 mol O2加入到V L的反应器中,在高温下放电,经t1 s建立了平衡体系:3O2 2O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是
2O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年云南省玉溪市高一上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.反应物均为离子的反应称为离子反应
B.在分液漏斗中注入碘水和四氯化碳,振荡、静置、分层,将分液漏斗下面的活塞拧开,流下的液体是碘的四氯化碳溶液
C.分液时,分液漏斗上下层液体均从下口放出
D.在CaCl2溶液中通入CO2,因生成CaCO3沉淀,符合离子反应条件,能发生反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区八校高一上学期期中联考化学试卷(解析版) 题型:选择题
下列物质中,属于纯净物的是
A.盐酸 B.液氯 C.生理盐水 D.漂白粉
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高二上学期期中化学试卷(解析版) 题型:实验题
(11分)(1)下图分别是温度计、量筒、滴定管的一部分,
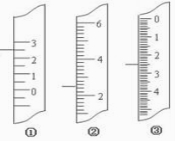
则:量筒应该是 读数为 mL,滴定管应该是 读数为 mL,温度计应该是 。
(2)实验室有一瓶混有氯化钠的氢氧化钠固体试剂,为了验证其纯度,用已知浓度的盐酸进行滴定,试回答下列问题:
①称取一定质量固体试剂配制100mL溶液。
②将标准盐酸装在25.00mL 滴定管中,调节液面位置在 ,并记下刻度。
③取20.00mL待测液,待测定。该项实验操作的主要仪器有 。
用 试剂作指示剂。
④下列实验操作会引起氢氧化钠含量偏高的是 。
A.滴定前滴定管尖嘴有气泡,滴定后滴定管尖嘴无气泡
B.中和滴定时,锥形瓶内有少量蒸馏水
C.酸式滴定管用蒸馏水洗后,用标准液润洗2-3次
D.读取滴定管终点读数时,仰视刻度线
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高二上学期期中化学试卷(解析版) 题型:选择题
在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液:Ca2+、H+、Cl-、HSO3 -
B.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3 -
C.Na2CO3溶液:K+、Fe3+、SO42-、NO3 -
D.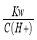 =0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高二上学期期中化学试卷(解析版) 题型:选择题
下列各组物质全部是弱电解质的是
A.H2O、 NH3·H2O、 H3PO4、 HF
B.Cu(OH)2、 CH3COOH、C2H5OH、CH3COONa
C.H2SO3、Ba(OH)2、 BaSO4 AgCl
D.H2SiO3、H2S、CO2
查看答案和解析>>
科目:高中化学 来源:2014--2015学年北京市高一上学期期中练习化学试卷(解析版) 题型:选择题
(每空1分,共6分)
写出除去下列物质中的杂质(括号内物质)所用的试剂,并写出发生的离子方程式。
(1)NaOH溶液(Na2CO3) , 。
(2)NaCl溶液(MgCl2) , 。
(3)KCl溶液(CuSO4) , 。
查看答案和解析>>
科目:高中化学 来源:2014--2015学年北京市高一上学期期中练习化学试卷(解析版) 题型:选择题
下列解释实验事实的离子方程式不正确的是
A.Fe与稀H2SO4反应放出气体:Fe + 6H+  2Fe3+ +3H2↑
2Fe3+ +3H2↑
B.稀H2SO4与BaCl2溶液反应生成沉淀:Ba2+ +SO42-  BaSO4↓
BaSO4↓
C.用大理石与稀盐酸制备CO2:CaCO3 + 2H+  Ca2+ + CO2↑+ H2O
Ca2+ + CO2↑+ H2O
D.碳酸钠溶液与足量稀盐酸:CO32- + 2H+  CO2↑+ H2O
CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应为
aTiO2 + bCl2+eC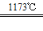 aTiCl4+eCO Ⅰ
aTiCl4+eCO Ⅰ
TiCl4+2Mg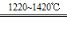 Ti+2MgCl2 Ⅱ
Ti+2MgCl2 Ⅱ
关于反应Ⅰ、Ⅱ的分析不正确的是
①TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂;②C、Mg在两个反应中均被还原;
③在反应Ⅰ、Ⅱ中Mg的还原性大于C,C的还原性大于TiCl4;
④a=1,b=e =2 ⑤每生成19.2 g Ti,反应Ⅰ、Ⅱ中共转移4.8 mol e-。
A.①②④ B.②③④ C.③④ D.②③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com