
 .
.分析 ①X元素的单质在Y元素的单质中燃烧发出苍白色火焰,并生成气体A,则X为H元素,Y为Cl元素,A为HCl;
②Z元素的单质与HCl溶液反应生成氢气,则Z为金属元素;
③Z元素的原子和Cl元素的原子电子层数相同,且它们的最外层电子数之差的绝对值为奇数,则Z的最外层有2个电子,所以Z为Mg元素;
④W元素的原子核外有3个电子层,其最外层电子数等于电子层数,则最外层电子数为3,所以W为Al元素;
结合元素化合物的性质及元素周期律解答.
解答 解:①X元素的单质在Y元素的单质中燃烧发出苍白色火焰,并生成气体A,则X为H元素,Y为Cl元素,A为HCl;
②Z元素的单质与HCl溶液反应生成氢气,则Z为金属元素;
③Z元素的原子和Cl元素的原子电子层数相同,且它们的最外层电子数之差的绝对值为奇数,则Z的最外层有2个电子,所以Z为Mg元素;
④W元素的原子核外有3个电子层,其最外层电子数等于电子层数,则最外层电子数为3,所以W为Al元素;
(1)X的元素符号为:H;Z的元素名称是:镁;
故答案为:H;镁;
(2)A为HCl,HCl分子是由1个氢原子和1个氯原子通过共用1对电子结合而成的共价化合物其电子式为 ,
,
故答案为: ;
;
(3)Mg与HCl溶液反应生成氯化镁和氢气,其反应的离子方程式为:Mg+2H++=Mg2++H2↑,故答案为:Mg+2H++=Mg2++H2↑;
(4)W为Al元素,其氧化物为两性氧化物,能与NaOH反应,其反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查了元素的推断和元素周期律的应用,注意把握元素单质及化合物的转化关系、常用化学用语书写等,题目难度不大,注意基础知识的掌握.


科目:高中化学 来源: 题型:选择题
| A. | KOH和CaCl2既含有离子键,又含有共价键 | |
| B. | PH3各原子均满足8电子稳定结构 | |
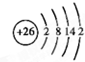
| C. | 硫离子的结构示意图: | |
| D. | NH4Cl的电子式: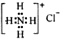 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
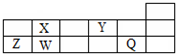
| A. | W、X两元素在自然界中都存在相应的单质 | |
| B. | Q、Y分别与钠元素形成的化合物中仅含离子键 | |
| C. | 简单离子半径由大到小的顺序为:Q>Y>Z | |
| D. | X、Z的最高价氧化物对应的水化物之间易发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g)△H<0.500℃,5MPa条件下,将0.20mol CO与0.58mol H2的混合气体充入2L恒容密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示
工业上合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g)△H<0.500℃,5MPa条件下,将0.20mol CO与0.58mol H2的混合气体充入2L恒容密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生利用物质间的互变,设计成一个平面魔方,如图所示:
某学生利用物质间的互变,设计成一个平面魔方,如图所示:| 纯A(单质) | B溶液 | C固体 | D固体 | G溶液 |
| 颜色 | 银白色(粉末状时为黑色)黄色红 | 褐色 | 红棕色 | 浅绿色 |
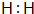 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com