
【题目】下列各组离子在指定溶液中,可能大量共存的是( )
A. 加入铝能放出H2的溶液中:NH4+、Na+、Cl-、Br-
B. 水电离出的c(H+)=10-13mol·L-1的溶液中:Fe3+、K+、CO32-、SO32-
C. 室温下, Kw/c(H+)=0.1mol·L-1的溶液中:Al3+、Na+、SiO32-、HCO3-
D. 使石蕊变红的溶液中:Fe2+、K+、ClO-、SO42-
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物进行相互反应,生成无毒物质;或者使用新型燃料电池作汽车动力,减少汽车尾气污染.
(1)H2或CO可以催化还原NO以达到消除污染的目的.
已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJmol﹣1
2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJmol﹣1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是 .
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.图表示在其他条件不变时,反应:2CO(g)+2NO(g)2CO2(g)+N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.
①该反应的△H0 (填“>”或“<”).
②若催化剂的表面积S1>S2 , 在右图中画出c (NO) 在T1、S2条件下达到平衡过程中的变化曲线 . 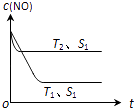
(3)在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:![]()
时间/s | 0 | 1 | 2 | 3 | 4 |
c (NO)(×10﹣3 molL﹣1) | 1.00 | 0.50 | 0.20 | 0.10 | 0.10 |
c (CO)(×10﹣3 molL﹣1) | 3.00 | 2.50 | 2.20 | 2.10 | 2.10 |
不考虑温度变化对催化剂催化效率的影响,按要求完成以下计算(写出计算过程,只写出计算结果的不给分):①计算前2s内的△c (CO2);
②计算前2s内的平均反应速率v (N2);
③计算达到平衡时NO的转化率.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() H、
H、 ![]() H、
H、 ![]() H三种核素的性质不同
H三种核素的性质不同
B.16O2、18O2彼此是同位素
C.14N、14C两种核素的中子数相同,质子数不同
D.白磷与红磷是磷元素的两种同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习物质结构和性质的重要工具,如图是元素周期表的一部分,请参照元 素①﹣⑩在表中的位置回答下列问题. 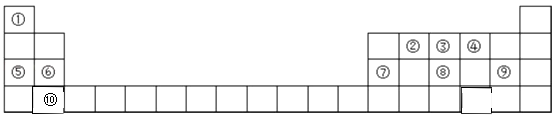
(1)在这 10 种元素中,原子半径最大的是(填元素符号).
(2)⑧、⑨的最高价氧化物对应水化物的酸性强弱顺序是 . (填化学式)
(3)写出⑨形成的单质和水反应的离子方程式 .
(4)写出①、④元素组成的化合物的电子式是、 .
(5)④⑤⑥⑦对应的离子半径最小的是(填离子符号).
(6)写出实验室制取③的气态氢化物的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组为探究某种铝合金(合金元素为 Mg、Al)是否符合国家质量标准(国 家规定其中铝含量不能低于 78%),设计如图所示装置进行实验. 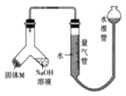
(1)如何检验该装置的气密性?
(2)合金样品固体 M 与氢氧化钠溶液反应的离子方程式是 .
(3)倾斜左边装置使氢氧化钠溶液(足量)与质量为 a 的合金粉末(固体 M)充分反应,待反应停止后,进入量气管气体的体积为 V mL(已折算成标准状况).若量气管最大量 为 50mL,则固体 M 中铝的质量[m(Al)]范围为 .
(4)为了准确地测量氢气的体积,在读取量气管中液面读数的过程中,应注意:①读数时 视线与凹液面最低处相平,②
(5)若 a=38mg,V=44.8mL(标准状况),通过计算可知,该合金中铝的质量分数为(精确到小数点后 1 位).
(6)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积(填“>”“<”或“=”)V.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分.
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
一 | ① | |||||||
二 | ② | ③ | ④ | ⑤ | ⑥ | |||
三 | ⑦ | ⑧ | ⑨ | ⑩ | ||||
四 | ||||||||
(1)表中元素的非金属性最强;元素的金属性最强;元素的单质室温下呈液态(填写元素符号);
(2)表中元素⑦的原子结构示意图为
(3)表中元素⑥⑩氢化物的稳定性顺序为>(填写化学式,下同);
(4)表中元素⑩和最高价氧化物对应水化物的酸性:> .
(5)表中元素②和⑦最高价氧化物对应水化物的碱性> .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com