

| A.做该实验时环境温度为22 ℃ |
| B.该实验表明化学能可以转化为热能 |
| C.NaOH溶液的浓度约为1.00 mol·L-1 |
| D.该实验表明有水生成的反应都是放热反应 |
科目:高中化学 来源:不详 题型:单选题
| | 实验事实 | 热化学方程式 | 评价 |
| A | 已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1,将稀硫酸与稀氢氧化钡溶液混合 | H2SO4(aq)+Ba(OH)2(aq) =BaSO4(s)+ 2H2O(l) △H=-114.6 kJ·mol-1 | 正确 |
| B | 醋酸与稀氢氧化钠溶液混合 | CH3COOH(aq)+NaOH(aq) =CH3COONa(aq)+H2O(l) △H=-57.3kJ·mol-1 | 不正确;因为醋酸状态为“aq”,而不是“l”。 |
| C | 160 g SO3气体与适量水恰好完全反应生成H2SO4,放出热量260.6 kJ | SO3(g)+H2O(l)=H2SO4(aq) △H=-130.3 kJ·mol-1 | 不正确;因为反应热为△H=-260.6kJ·mol-1 |
| D | 已知25℃、101 kPa下,120g石墨完全燃烧放出热量3935.1 kJ | C(s)+O2(g)=CO2(g) △H=-393.51 kJ·mol-1 | 不正确;同素异形体要注名称:C(石墨) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.2SO2+O2 2SO3 ΔH=-196.6 kJ·mol-1 2SO3 ΔH=-196.6 kJ·mol-1 |
| B.C(g)+O2(g)=CO(g) ΔH=393.5 kJ·mol-1 |
C.H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ O2(g)=H2O(g) ΔH=-241.8 kJ |
| D.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量可能相同 |
| B.在101kPa时,1mol物质燃烧时的反应热叫做该物质的标准燃烧热 |
| C.热化学方程式中,各物质前的化学计量数不表示分子个数 |
| D.如果反应物所具有的总能量小于生成物所具有的总能量,则该反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 SO3(g) ΔH="-98.32" kJ·mol-1,在容器中充入2 mol SO2和1 mol O2,充分反应,最终放出的热量( )
SO3(g) ΔH="-98.32" kJ·mol-1,在容器中充入2 mol SO2和1 mol O2,充分反应,最终放出的热量( )| A.="196.64" kJ | B.="98.32" kJ |
| C.<196.64 kJ | D.>196.64 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量/kJ | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
 2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: ______________。
2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: ______________。 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
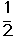 O2(g) →
O2(g) →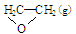 ; △H1 ②C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g); △H2
; △H1 ②C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g); △H2查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-2.92 kJ·mol-1 |
| B.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-18 kJ·mol-1 |
| C.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-73 kJ·mol-1 |
| D.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-0.72 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com